
科目: 来源: 题型:
【题目】从镍钼矿渣(主要含有MoO3、NiO、MgO和Fe2O3)中提取元素,其主要工业流程如图:
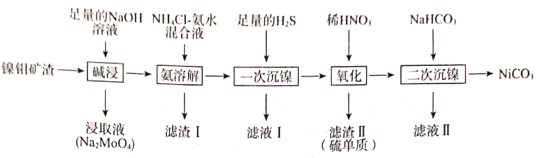
已知:①MoO3难溶于水,可溶于强碱溶液。
②Fe2O3、MgO不溶于NH4Cl—氨水混合液,NiO可溶于NH4Cl—氨水混合液生成[Ni(NH3)6]2+。
③已知部分金属离子形成氢氧化物沉淀的pH见下表:
pH(开始沉淀) | pH(完全沉淀) | |
Fe3+ | 1.52 | 3.18 |
Mg2+ | 8.10 | 9.43 |
请回答下列问题:
(1)“碱浸”时应先将镍钼矿渣粉碎,再与NaOH在80℃下反应2小时,该操作的目的为___。
(2)“碱浸”时,MoO3发生反应的离子方程式为___。
(3)“氨溶解”的目的为___,“氨溶解”过程中反应条件的选择性实验数据如图所示,“氨溶解”过程中需要控制温度在50~70℃之间,温度过高或过低都会导致产品的产量降低,请解释原因___。

(4)简述利用“滤渣I”制备纯净的铁红的方法:___。
(5)“一次沉镍”时加入H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为___。
(6)“氧化”时发生反应的氧化剂与还原剂的物质的量之比为___。
(7)“二次沉镍”时,发生反应的离子方程式为___。
(8)已知:某温度时,Ksp(NiC2O4)=4.0×10-10,Ksp(NiCO3)=1.60×10-8。此温度下,将碳酸镍固体投入到1L一定浓度的Na2C2O4溶液中,若要一次性恰好将1molNiCO3完全转化成NiC2O4,则所需Na2C2O4溶液的浓度c(Na2C2O4)=___(忽略溶液体积的变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式____。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol·L-1的NaOH溶液,试管中溶液呈___色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈___色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡____(填“向左移动”或“向右移动”),溶液颜色将___。
(2)现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向___反应方向移动,正反应为____(填“吸热”或“放热”)反应,平衡时B、C的浓度之比![]() 将____。(填“增大”“减小”或“不变”,下同)。
将____。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向___反应方向移动, A的质量分数___,且m+n__p(填“>”或“<”)。
③若容积不变加入B,则B的转化率____,A的转化率____。
④若加入催化剂,平衡时气体混合物的总物质的量____。
⑤恒温恒容时,通入氦气,A的质量分数____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物W在医药和新材料等领域有广泛应用,其合成路线如图所示:

已知以下信息:
①1molY完全反应生成2molZ,且在加热条件下Z不能和新制的氢氧化铜反应
② +R1COOH
+R1COOH
③R1CH2NH2 +H2O(R1、R2、R3代表烃基)
+H2O(R1、R2、R3代表烃基)
回答下列问题:
(1)Y的化学名称是___________,Z中的官能团名称是___________。
(2) 中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
中___________(填“有”或“无”)手性碳原子,①的反应类型是___________。
(3)反应③所需的试剂和条件是___________。
(4)反应⑤的化学方程式为___________。
(5)G是对硝基乙苯的同分异构体,G能和碳酸氢钠反应产生气体且分子中含有氨基(-NH2),G的可能结构共有___________种(不考虑立体结构);其中核磁共振氢谱为五组峰,峰面积比为2:2:2:2:1的结构简式为___________。
(6)已知氨基(-NH2)易被酸性KMnO4溶液氧化。设计由甲苯和丙酮为原料制备药物中间体![]() 的合成路线:___________(无机试剂任选)。
的合成路线:___________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二茂铁[Fe(C5H5)2,结构简式为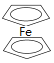 ,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
,广泛应用于航天、化工等领域中。实验室制备二茂铁的装置如图所示。
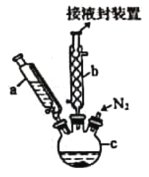
已知:①二茂铁熔点是173 ℃,在100 ℃时开始由固体直接变为气体;沸点是249 ℃。
②制备二茂铁的反应原理为2KOH+FeCl2+2C5H6=Fe(C5H5)2+2KCl+2H2O。
实验步骤为:
①在三颈烧瓶中加入16.8 g粉末状的KOH,并从仪器a中加入60 mL无水乙醚到烧瓶中,充分搅拌,同时通氮气5 min左右;
②再从仪器a滴入13.9 mL新蒸馏的环戊二烯(C5H6,密度为0.95 g/cm3),搅拌;
③将25.4 g无水FeCl2与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25 mL装入仪器a中,慢慢滴入仪器c中,45 min滴完,继续搅拌45 min;
④再从仪器a加入25 mL无水乙醚,搅拌;
⑤将c中的液体转入分液漏斗中,依次用盐酸、水各洗涤两次,分液得到橙黄色溶液;
⑥蒸发橙黄色溶液,得到二茂铁粗产品;
⑦二茂铁粗产品的提纯。
回答下列问题:
(1)仪器b的名称是________________。
(2)步骤①中通入氮气的目的是________________。
(3)仪器c的适宜容积应为________________(填标号)。
A. 100 mL B. 250 mL C. 500 mL D. 1000 mL
(4)步骤⑤用盐酸洗涤的目的是________________.
(5)步骤⑦的实验装置如图所示,二茂铁在扎有小孔的滤纸上凝结,该分离提纯方法的名称是________________,装置中棉花的作用是________________。
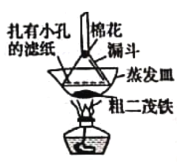
(6)为了确认得到的是二茂铁,还需要进行的一项简单实验是________________。
(7)若最终制得纯净的二茂铁11.16 g,则该实验的产率为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:

回答下列问题:
(1)该结构基态P原子中,核外电子占据最高能层的符号是________________,占据该能层电子的电子云轮廓图形状为________________。
(2)瑞德西韦中位于第二周期元素的第一电离能从大到小的顺序为________________,分子中氮原子的杂化类型有________________。
(3)苯酚(![]() )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(![]() )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韦的催化剂之一。MgSO4中,阴离子的空间构型为________________。
(5)磷酸也是合成瑞德西韦的原料之一。直链的多磷酸盐则是-种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
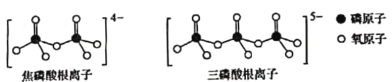
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
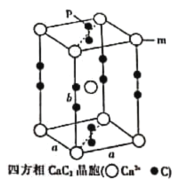
(6)合成瑞德西韦的原料之一的苯酚可通过如下途径制得:电石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化钙(CaC2)晶体的晶跑结构如图所示.其晶胞参数分别为apm、apm、bpm,四方相碳化钙晶体的密度为![]() g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+ 6CO(g)。
Si3N4(s)+ 6CO(g)。
(1)该反应的氧化剂是___;
(2)该反应的平衡常数表达式为K=___;
(3)若知上述反应为放热反应,升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18mol·L-1·min-1,则N2消耗速率为v(N2)=___。
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是___;
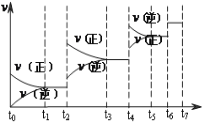
图中表示平衡混合物中CO的含量最高的一段时间是___。
(5)若该反应的平衡常数为K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2molN2充分反应,则N2的转化率是___(提示:272=729)
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
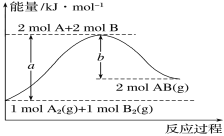
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】CH3CH2CH2CH3(g)+![]() O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+
O2(g)=4CO2(g)+5H2O(l) ΔH=-2878kJ/mol,(CH3)2CHCH3(g)+![]() O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
O2(g)=4CO2(g)+5H2O(l)ΔH=-2869kJ/mol,下列说法正确的是
A.正丁烷与异丁烷的能量大小关系如图
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室制取纯净氯气的装置图,下列说法正确的是( )
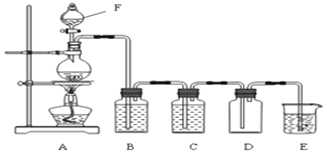
A.分液漏斗中盛装的是浓硫酸
B.B的目的是为了除去氯气中的水分
C.E的目的是为了处理过量的氯气,E中盛装的是Ca(OH)2溶液
D.D广口瓶除了可以用于收集气体外,还可以用做安全瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家发现用二氧化钛(TiO2)作催化剂可以使水在光照条件下分解制得廉价的氢气,这使氢能源的研究和应用更向前迈进了一步。下列说法正确的是( )
A.使用二氧化钛作催化剂使水快速分解的同时放出大量热
B.催化剂的作用是通过改变反应的活化能来影响反应速率
C.该反应的原理是:2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
D.每产生氢气44.8L,转移电子数目为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com