
科目: 来源: 题型:
【题目】下列叙述正确的是
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Cl2是一种有毒气体,不可用于自来水的杀菌消毒
C.SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
D.Na2SiO3水溶液俗称水玻璃,是制备硅胶和木材防火剂等的原料
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,22gCO2含有的氧原子数为NA
B.标准状况下,2.24 L CCl4含有的分子数为0.1NA
C.常温常压下,0.1molL-1的MgCl2溶液中含Cl-数为0.2NA
D.常温常压下,5.6g铁与足量Cl2完全反应,转移电子数为0.2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的操作正确的是
实验目的 | 实验操作 | |
A | 配制浓度为0.010 | 用托盘天平称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
B | 浓盐酸与MnO2反应制备纯净Cl2 | 气体产物先通过浓硫酸,后通过饱和食盐水 |
C | 配制稀硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
D | 排水法收集KMnO4分解产生的O2 | 先移出导管,后熄灭酒精灯 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:2X(g)+ 2Y(g)![]() Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2 W(g)△H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)=0.2 mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某铝土矿中主要含有Al2O3、Al(OH)3还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如图所示:
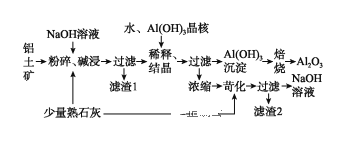
请回答下列问题:
(1)粉碎后的铝土矿碱浸时应在较高温度下进行,其目的是____________________。滤渣1的主要成分为________________。
(2)Al2O3与NaOH溶液反应的离子方程式为____________________________________。
(3)加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的_________气体的方法来代替。(已知:通入该气体后,其产物之一可用来做发酵粉)。
(4)焙烧过程中发生的化学方程式为_________________________________。
(5)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化(即与少量熟石灰反应)反应除去,写出苛化反应的化学方程式:_________________________________________________。
(6)该生产流程能实现____________________(填化学式)的循环利用。
查看答案和解析>>
科目: 来源: 题型:
【题目】绿矾(FeSO47H2O)可用做净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,流程如下:
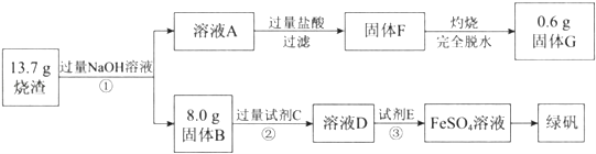
请回答下列问题:
(1)溶液A中含有的阴离子主要有AlO2-、SiO32-和______。
(2)试剂C是______。
(3)③中反应的离子方程式是_______、_______。
(4)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。提示:黄緑色气体乙是氯气。

请回答下列问题:
(1)写出下列物质的化学式:B______,丙______,H______。
(2)根据要求回答:
①D溶液和F溶液在空气中混合的现象:_______;
②反应③离子方程式________;
③反应⑦离子方程式________;
④反应⑥化学方程式________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
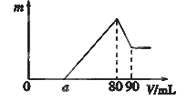
(1)80-90ml对应反应的离子方程式_____________;
(2)金属铝的质量为____________g;
(3)盐酸的体积是____________mL;
(4)a的取值范围是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)标准状况下,用一定量的水吸收氨气后制得浓度为12.0mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收________体积的氨气可制得上述氨水。(水的密度以1.00g/cm3计)
(2)硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2![]() 8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
8SO2+2Fe2O3设空气中N2、O2的含量分别为0.800和0.200(体积分数),试完成下列各题:
①1.00molFeS2完全氧化,需要空气的体积(标准状况)为_______L。
②55L空气和足量FeS2完全反应后,气体体积(同温同压)变为_______L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com