
科目: 来源: 题型:
【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
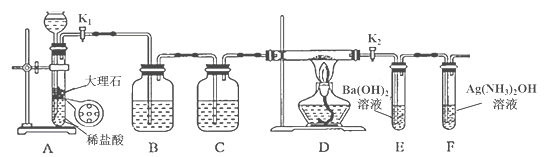
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图示方法不能完成相应实验的是
A.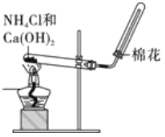 实验室制取并收集NH3
实验室制取并收集NH3
B.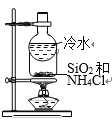 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C. 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D.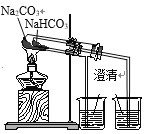 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列几种物质:①盐酸;②Na2O;③Na2O2;④Al(OH)3;⑤Na2CO3;⑥H2O;⑦CO2;⑧乙醇;⑨Cu;⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴元素由于其良好的物理化学性质,被广泛应用于生产生活中。从含钴废料(含CoO、Co2O3、单质Al、Li等)中制取粗CoCl2·6H2O的流程如下所示。
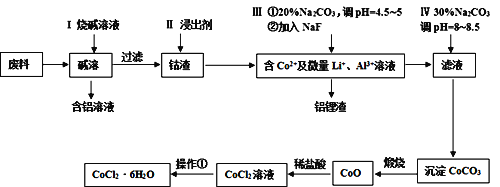
请回答下列问题:
(1)步骤I中主要发生的化学反应方程式为______。
(2)已知Co2O3具有强氧化性,若步骤II中浸出剂为盐酸,造成的后果是_______。
(3)步骤Ⅲ中①的目的是除去Al3+,写出该步反应的离子方程式______。
(4)若在实验室煅烧CoCO3,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有______、______(填仪器名称)。
(5)操作①是在HCl氛围中进行的,其步骤是______、_____、过滤、洗涤、干燥。洗涤过程中可以用工业酒精代替水,其优点是_____。
(6)某同学用标准硝酸银溶液滴定未知浓度的CoCl2溶液,下列可作为指示剂的是____(填选项,忽略亚钴离子的颜色干扰)
A.KCl B.KSCN C.K2CrO4 D.K2S
已知几种物质在20℃时的颜色及Ksp值如下表
化学式 | AgCl | AgSCN | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黑色 | 红色 |
Ksp | 2.0×10-10 | 1.0×10-12 | 2.0×10-48 | 2.0×10-12 |
查看答案和解析>>
科目: 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH![]() 、K+、Mg2+、Cu2+、Al3+、NO
、K+、Mg2+、Cu2+、Al3+、NO![]() 、CO
、CO![]() 、SO
、SO![]() ,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

A. 原溶液一定不存在H+、Cu2+、CO![]()
B. 不能确定原溶液是否含有K+、NO![]()
C. 原溶液确定含Mg2+、Al3+、NH![]() ,且n(Mg2+) ︰ n(Al3+) ︰ n(NH
,且n(Mg2+) ︰ n(Al3+) ︰ n(NH![]() )=1︰1︰2
)=1︰1︰2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。

已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为 1.0 L 的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
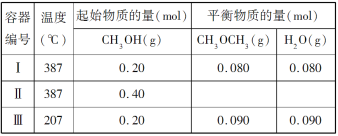
下列说法正确的是( )
A.该反应的正反应为吸热反应
B.达到平衡时,容器Ⅰ中的 CH3OH 体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入 CH3OH 0.15 mol、CH3OCH3 0.15 mol 和 H2O 0.10 mol,则反应将 向正反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】中药葛根是常用祛风解表药物,它的有效成分为葛根大豆甙元 F, 已用于治疗高血压引起的头疼、头晕、突发性耳聋等症。以下是以 A 为起始原料合成F 的一种方法:

回答下列问题:
(1) A 的化学名称为________________,B分子式为________________。
(2) C 中官能团的名称为________ , C→D的反应类型为 ______________。
(3)l molE 最多可与_____________________molH2 发生加成反应。
(4) F 与NaOH 溶液反应的化学方程式为 ________________。
(5)B 有多种同分异构体,同时满足下列条件的共有________种。
①属于芳香族化合物 ②可与NaHCO3溶液反应放出 CO2气体.其中,核磁共振氢谱有4 组峰,且峰面积之比为1:2:6:1的结构简式为 _________________(写出一种即可).
(6)已知:![]() 写出以A为原料制备化合物
写出以A为原料制备化合物![]() 合成路线____________________________ 。(无机试剂任选)
合成路线____________________________ 。(无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢溴酸常用于合成镇静剂和麻醉剂等医药用品。已知: 液溴是易挥发的深红棕色液体,沸点为58.78℃。质量分数为47%的氢溴酸是易挥发的无色液体,沸点 为 126℃. 实验室制备质量分数为47%的氢溴酸的一种方法如下。回答下列问题:
实验橾作 | 现象 |
I .向锥形瓶中依次加入适量冰水、m1g 液溴,再通入SO2充分反应 | 得到淡黄色溶液 |
II. 将操作 I 所得溶液转移至蒸馏烧瓶,蒸馏 | 锥形瓶中得橙黄色粗产品 |
III.在不断搅拌下,向锥形瓶中加入适量Na2SO3溶液 | (1)①_____ |
IV.继续加入适量 Ba(OH)2 溶液 | ②______ |
V.过滤,滤液经蒸馏后得质量分数为47%的氢溴酸m2g |
(2)操作 II的蒸馏装置如图所示(部分夹持装置省略),仪器a的名称是_________ ,装置中除缺石棉网外还有两处明显错误,分别是_________、 _______________。
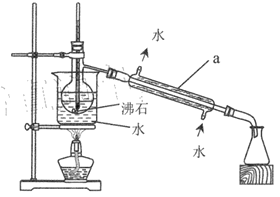
(3)操作III加入适量Na2SO3 发生反应的离子方程式为 __________。
(4)工业生产制得的氢溴酸常常有淡淡的黄色, 有同学推测是因为含Fe3+,可用试剂 __________检验。若观察到的现象为________,则推测正确。
(5)质量分数为 47%的氢溴酸的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A. 1mol/L B. 2 mol/L C. 0.5 mol/L D. 1.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com