
科目: 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】在目前市面上防护新冠病毒的消毒剂中,二氧化氯消毒剂是相对高效更安全的产品。二氧化氯的熔点为![]() ,沸点为
,沸点为![]() ,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的
,易溶于水但不与水反应,在生产和使用时必须用空气、二氧化碳、氮气等“惰性”气体进行稀释,但温度过高、气相浓度过大时均易发生爆炸。工业上用稍潮湿的![]() 和草酸在
和草酸在![]() 时反应制得(如下图所示),在
时反应制得(如下图所示),在![]() 装置内用冷水吸收
装置内用冷水吸收![]() 。
。
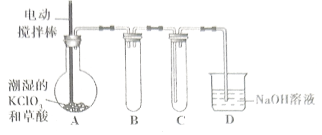
(1)装置A中发生反应:![]() (未配平),当生成
(未配平),当生成![]() 时,同时产生标准状况下
时,同时产生标准状况下![]() 的体积是______
的体积是______![]() 。
。
(2)实验时,对A装置进行加热操作还需要的玻璃仪器有酒精灯、_____、_______。
(3)本实验哪些设计从实验安全角度考虑______。(填2条)
(4)装置D中,![]() 与
与![]() 溶液反应可生成两种盐,且二者物质的量之比为
溶液反应可生成两种盐,且二者物质的量之比为![]() ,其中一种是
,其中一种是![]() 。
。
①写出![]() 与
与![]() 溶液反应的离子方程式_______。
溶液反应的离子方程式_______。
②已知饱和![]() 溶液随温度变化情况如下图:
溶液随温度变化情况如下图:
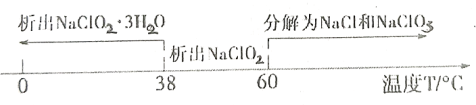
从![]() 溶液中获得
溶液中获得![]() 晶体的操作步骤为:减压蒸发结晶→______→______→
晶体的操作步骤为:减压蒸发结晶→______→______→![]() 干燥,得到成品。(选择合适的操作编号填空)
干燥,得到成品。(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤 D.冰水洗涤 E.![]() 的温水洗涤
的温水洗涤
采用减压蒸发的原因是_____。
(5)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,![]() 、
、![]() 、
、![]() 三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
三种消毒杀菌剂的消毒效率由小到大的顺序是____(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。
是元素周期表中前四周期的元素,各周期至少含有一种元素,且原子序数依次增大。![]() 、
、![]() 、
、![]() 三种元素原子的最外层电子数相同,
三种元素原子的最外层电子数相同,![]() 与
与![]() 能够形成原子之比为
能够形成原子之比为![]() 的化合物
的化合物![]() ,
,![]() 是前四周期基态原子含有未成对电子数目最多的元素,
是前四周期基态原子含有未成对电子数目最多的元素,![]() 与
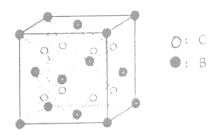
与![]() 形成的晶体
形成的晶体![]() 结构如图所示。试用元素符号回答下列问题:
结构如图所示。试用元素符号回答下列问题:
(1)![]() 、
、![]() 、
、![]() 三种元素的电负性由大到小的顺序为_______。
三种元素的电负性由大到小的顺序为_______。
(2)![]() 与
与![]() 两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
两种元素能够形成两种常见的化合物,则在这两种化合物分子中,原子的杂化方式分别为______和______,且这两种分子____(填选项)。
A 都是极性分子 B 都是非极性分子 C 其中一种是极性分子另一种是非极性分子
(3)![]() 元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
元素处于周期表的____区,其单质晶体堆积模型的名称为_____。
(4)![]() 元素的基态原子价层电子排布图为______。
元素的基态原子价层电子排布图为______。
(5)已知![]() 能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与
能溶于某浓度的硝酸中,得到蓝色溶液的同时,会逸出一种与![]() 互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由
互为等电子体的纯净气体,则该反应的化学方程式为_____。经研究证实,所得溶液呈蓝色,是因为溶液中含有由![]() 、
、![]() 、
、![]() 三种元素形成的一种配位离子,试写出该离子的结构式______。
三种元素形成的一种配位离子,试写出该离子的结构式______。
(6)由晶体![]() 的晶胞可知,
的晶胞可知,![]() 离子呈简单立方堆积模型,形成立方体空隙,则
离子呈简单立方堆积模型,形成立方体空隙,则![]() 离子对这些立方体空隙的填充率为_____
离子对这些立方体空隙的填充率为_____![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,向容器中同时通入甲烷、氧气和水蒸气三种气体,发生的化学反应有:
反应过程 | 化学方程式 | 焓变
| 活化能
|
甲烷氧化 |
|
|
|
|
|
| |
蒸汽重整 |
|
|
|
|
|
|
(1)已知:![]() ,则
,则![]() 燃烧热
燃烧热![]() _____。
_____。
(2)在初始阶段,甲烷蒸汽重整的反应速率小于甲烷氧化的反应速率,原因可能是______。
(3)恒温恒压体系(温度为![]() ,压强为
,压强为![]() ),反应
),反应![]() 达到平衡时,各气体的物质的量均为
达到平衡时,各气体的物质的量均为![]() ,用某气体组分
,用某气体组分![]() 的平衡分压(分压=总压×物质的量分数)代替物质的量浓度
的平衡分压(分压=总压×物质的量分数)代替物质的量浓度![]() 也可表示平衡常数(记作
也可表示平衡常数(记作![]() )。则:
)。则:
①平衡常数![]() ___。
___。
②再向容器中瞬时同时充入![]() 、
、![]() 、
、![]() 、
、![]() ,此时
,此时![]() (正)____
(正)____![]() (逆)(填“>”“<”或“=”)
(逆)(填“>”“<”或“=”)
③恒温恒容条件下,将![]() 、
、![]() 、
、![]() 、
、![]() 按照体积比
按照体积比![]() 投料,能判断反应
投料,能判断反应![]() 达到平衡状态的是____。
达到平衡状态的是____。
A 密度保持不变 B ![]() 体积分数保持不变
体积分数保持不变
C 平均摩尔质量保持不变 D ![]() 和
和![]() 的比保持不变
的比保持不变
E ![]() 断裂的同时,有
断裂的同时,有![]() 断裂
断裂
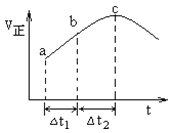
(4)向绝热恒容密闭容器中通入![]() 和
和![]() 使反应
使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示。图中
达到平衡,正反应速率随时间变化的示意图如图所示。图中![]() 点反应是否达到平衡,说明理由_____。
点反应是否达到平衡,说明理由_____。
(5)利用重整反应![]() ,设计一种熔融碳酸盐燃料电池,原理示意图,电极
,设计一种熔融碳酸盐燃料电池,原理示意图,电极![]() 上发生的电极反应为______。
上发生的电极反应为______。
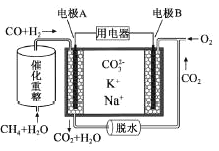
查看答案和解析>>
科目: 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】依据信息写出下列反应的方程式或填充合适的物质。
⑴氢氧化铟[In(OH)3]广泛应用于电子行业。以氧化铟废渣(主要含In2O3和Fe3O4)为原料制备氢氧化铟的一种工艺流程如下:
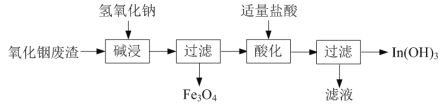
已知:In2O3为两性氧化物,在强碱性条件下In元素以InO33-离子形式存在。
①写出“碱浸”时反应的离子方程式:______。
②写出“酸化”时反应的离子方程式:______。
⑵下表所示为部分酸的电离平衡常数:
酸 | H2SO3 | CH3COOH | HCOOH |
电离平衡常数 | Ka1=1.2×10-2 Ka2=5.6×10-8 | 1.75×10-5 | 1.8×10-4 |
从H2SO3、CH3COOH中选择合适的物质,以实现HCOONa→HCOOH的转化,写出该反应的离子方程式:______。
⑶下表所示为部分物质的溶度积常数:
难溶物 | Mn(OH)2 | Co(OH)2 | MnCO3 |
溶度积常数 | 2×10-13 | 5.9×10-15 | 2.2×10-11 |
①从NaOH、Co(OH)2中选取合适的物质,填在如下转化关系中:MnCl2→Mn(OH)2。______
②NaNO3、Na2CO3中选择合适的物质,填在如下转化关系中:MnCl2→NaCl。_______
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向10mL 0.1 molL1一元弱碱XOH溶液中逐滴滴加0.1 molL1的HCl溶液,溶液的变化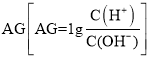 如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
如图所示(溶液混合时体积变化忽略不计)。下列说法正确的是( )
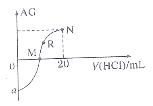
A.a的最小值是12
B.M点消耗盐酸的体积为10mL
C.R点溶液中可能存在![]()
D.M点到N点,水的电离程度逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl难溶于水,广泛应用于电镀、印染等行业。工业上用辉铜矿(CuS2)为原料制取CuCl的一种流程图如下:

⑴写出“氧化Ⅰ”反应的离子方程式:______。
⑵写出“氧化Ⅱ”反应的离子方程式:_____。
⑶写出“还原”反应的离子方程式:______。
⑷将Cl2通入热的NaOH溶液,可以制得含NaClO3的溶液,写出该反应的离子方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com