
科目: 来源: 题型:
【题目】有关新型冠状病毒肺炎的预防,下列说法正确的是( )
A.“84”消毒液和酒精均可用于消毒,混合使用效果更好
B.过氧乙酸![]() 和环氧乙烷
和环氧乙烷![]() 都是高效消毒剂,其杀菌原理相同
都是高效消毒剂,其杀菌原理相同
C.外科口罩对直径![]() 葡萄球菌气溶胶过滤效率不低于
葡萄球菌气溶胶过滤效率不低于![]() ,可用于分离溶液和胶体
,可用于分离溶液和胶体
D.某医用免洗消毒洗手液含有一定浓度的过氧化氢和乙醇,可有效消毒灭菌
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g)+bB(g)![]() cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
cC(g) △H= -Q kJmol-1(Q>0),12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如图所示。试计算:
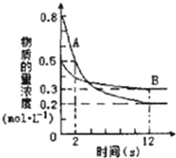
(1)前12s内,A的平均反应速率为______________。
(2)化学计量数之比b:c=______________。
(3)12s内,A和B反应放出的热量为__________(用Q表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。回答有关中和反应的问题。
(1)用0.1 mol Ba(OH)2配成稀溶液与足量稀硝酸反应,能放出_______kJ热量。
(2)如图装置中仪器A的名称是____________,碎泡沫塑料的作用是_____________________________;要重复进行三次实验的目的是 ____________________。
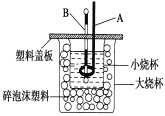
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会__________(填“偏大”、“偏小”、“无影响”)。
(4)将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是_____。
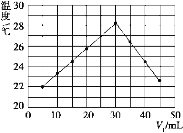
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
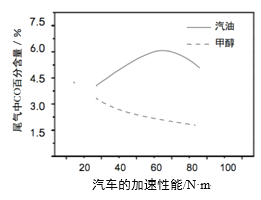
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯和乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后乙烯和乙烷充分燃烧,得到一氧化碳和二氧化碳的混合气体和45g水。
(1)一氧化碳和二氧化碳的混合气体总物质的量是_____,生成水的物质的量是____。
(2)当a=1时,乙烯和乙烷的物质的量之比是________。
(3)当a=1,且反应后一氧化碳和二氧化碳混合气体的物质的量是反应前氧气的2/3时,则b等于______,得到的一氧化碳和二氧化碳的物质的量之比是_____。
(4)a的取值范围是________,b的取值范围是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来____________________。
(2)解释下列化学反应的反应速率变化关系曲线
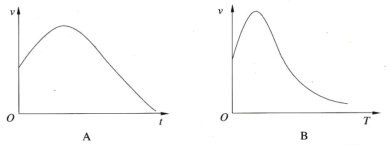
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:_________________________________________________________。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:______________________。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
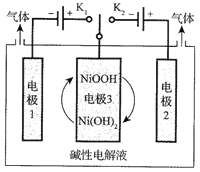
①制H2时,连接_______________。
②改变开关连接方式,可得O2,电极反应式为___________________________。
③结合①和②中电极3的电极反应式,说明电极3的作用:______________________________。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。
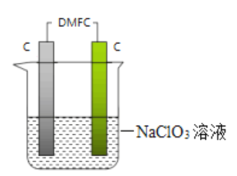
①写出电源负极电极反应式:______________________________。
②写出电解的总反应化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目: 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为:![]() ,已知该反应在不同温度下的平衡常数如下:
,已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式![]() ______,该反应的正反应是______反应(填“放热”、“吸热”)。
______,该反应的正反应是______反应(填“放热”、“吸热”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率![]() ______、CO的平衡转化率
______、CO的平衡转化率![]() ______;
______;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是______。
a.减少Fe的量 b.增加Fe2O3的量 c.移出部分CO2 d.提高反应温度e.减小容器的容积 f.加入合适的催化剂
(4)在氯氧化法处理含![]() 的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
①某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应(其中N均为![]() 价):
价):![]() 被氧化的元素是______。
被氧化的元素是______。
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目:
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() □
□![]() ______
______
③若处理上述废水40L,使KCN完全转化为无毒物质,至少需液氯______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组用如图装置(支撑仪器略去)探究乙醇的催化氧化反应。
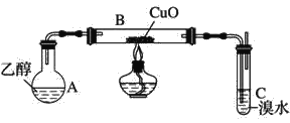
(1)实验开始时,对A进行水浴加热,其目的是__。
(2)B中反应方程式为__。
(3)若装置C中开始发生倒吸,则采取的应急措施是__(填编号)。
a.移去图中的酒精灯 b.将C中橡皮塞拔出
c.将B尾端的乳胶管取下 d.将A与B之间的乳胶管取下
(4)探究:充分反应后,观察到溴水完全褪色。学习小组通过测定反应前溴水中n(Br2)与反应后溶液中n(Br﹣)来确定乙醛使溴水褪色的原因。
①假设:请写出假设1的反应类型。
假设1:CH3CHO+Br2→CH2BrCHO+HBr__;
假设2:CH3CHO+Br2→CH3CHBrOBr 加成反应;
假设3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反应。
①结论:若实验测得n(Br2)=0.005mol,n(Br﹣)=0.01mol,则证明假设__正确。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com