
科目: 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.常温下,pH=13的NaOH溶液中含有的OH-数目为0.1NA
B.100mL12mol·L-1浓硝酸与过量Cu反应转移电子的数目为0.6NA
C.电解精炼铜时,若阳极质量减少64g,则阴极得到电子的数目为2NA
D.14g聚丙烯中含C—H键总数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.用于新版人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
B.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
C.纳米级的钛白可由TiCl4水解制得:TiCl4+2H2O![]() TiO2+4HCl
TiO2+4HCl
D.被誉为“中国天眼”的射电望远镜,其“眼眶”的结构钢梁属于合金材料
查看答案和解析>>
科目: 来源: 题型:
【题目】A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2(g) ![]() N2O4(g) ΔH<0)
N2O4(g) ΔH<0)
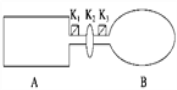
(1)一段时间后,反应达到平衡,此时A、B中生成N2O4的速率是vA______vB(填“>”、“<”或“=”);若打开活塞K2,气球B将______(填“变大”、“变小”或“不变”).
(2)关闭活塞K2,若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率αA将________(填“增大”、“减小”或“不变”);若分别通入等量的氖气,则达到平衡时,A中NO2的转化率将________,B中NO2的转化率将______(填“变大”、“变小”或“不变”).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,______中的颜色较深.
(4)若在容器A中充入4.6 g的NO2,达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为___________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】用![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.100g 98%![]() 溶液中含氧原子数为
溶液中含氧原子数为![]()
B.28g![]() 与
与![]() 混合气体中含有原子的数目为
混合气体中含有原子的数目为![]()
C.标准状况下,11.2L![]() 含有的分子数为
含有的分子数为![]()
D.含有![]() 个氧原子的氧气在标准状况下的体积为22.4L
个氧原子的氧气在标准状况下的体积为22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2 ,还含有少量Fe2O3、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
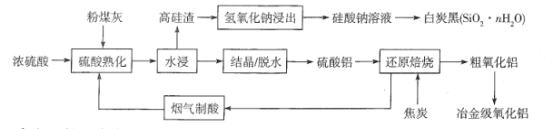
硫酸熟化过程中发生的反应有:
Al2O32SiO2 +3H2SO4=Al(SO4)3 +2SiO2 +3H2O
3Al2O32SiO2 +9H2SO4=3Al2( SO4)3 + 2SiO2 +9H2O
(1)“结晶”操作:缓缓加热,浓缩至______ ,放置冷却,得到Al2(SO4)318H2O。
(2)Al2(SO4)318H2O在250 ~300℃下失重40.5%得Al2(SO4)xH2O,x=______。
(3)“还原焙烧”过程中发生反应的化学方程式为_________。
(4)设计实验检验粗氧化铝中是否含有Fe2O3: __________。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为___________。
(6)粗氧化铝制备冶金级氧化铝过程中发生反应[ Al(OH)4]- +CO2 =Al(OH)3↓+ HCO3- ,该反应的平衡常数为_______[已知 Al(OH)3+H2O![]() [ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3
[ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3![]() H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是( )
A.![]() 胶体能吸附水中的悬浮颗粒并沉降,常用于净水
胶体能吸附水中的悬浮颗粒并沉降,常用于净水
B.浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C.用激光笔照射![]() 溶液和
溶液和![]() 胶体时,产生的现象相同
胶体时,产生的现象相同
D.胶态磁流体治癌术是将磁性物质制成胶体粒子,这种粒子的直径在![]() 之间
之间![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
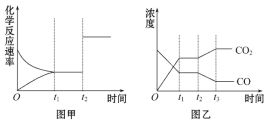
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____(填“放热”或“吸热”)反应。
②乙容器在50min时达到平衡状态,则NO的浓度是______,0~50min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
(2)用焦炭还原NO2的反应为:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、C两点的浓度平衡常数关系:Kc(A)_______Kc(C)(填“<”、“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”、“B”或“C”)点。
③计算B点时该反应的压强平衡常数Kp(B)=________(Kp是用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】据报道,某种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用较长时间。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH![]() 2K2CO3+6H2O。
2K2CO3+6H2O。
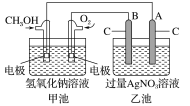
请填空:
(1)充电时,①燃料电池的负极与电源________极相连。
②阳极的电极反应式为:________________________。
(2)放电时:负极的电极反应式为:__________________。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2____________L(标准状况)。
(4)若在常温常压下,1 g CH3OH燃料生成CO2和液态H2O时放热22.68 kJ,表示该反应的热化学方程式为:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.20.0g![]() 溶解在1L水中,所得溶液的物质的量浓度为
溶解在1L水中,所得溶液的物质的量浓度为![]()
B.从1L![]() 溶液中取出0.5L,取出的溶液浓度为
溶液中取出0.5L,取出的溶液浓度为![]()
C.配制1L![]() 溶液,需用5.85g
溶液,需用5.85g![]() 固体
固体
D.常温常压下,将2.24L![]() 气体溶于水制得100mL溶液,其物质的量浓度为
气体溶于水制得100mL溶液,其物质的量浓度为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com