
科目: 来源: 题型:
【题目】阿比朵尔可用于合成一种治疗新型冠状病毒肺炎的试用药物,实验室以芳香化合物A 为原料合成阿比朵尔的一种合成路线如下:
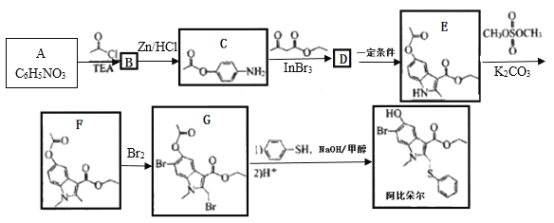
已知:![]()
请回答:
(1)A的化学名称为_________; B的结构简式为_________。
(2)阿比朵尔中含氧官能团的名称为________;由E生成F的反应类型为_______。
(3)由C生成D的化学方程式为___________。
(4)C的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器为 ___(填选项字母)。
A. 质谱仪 B. 红外光谱仪 C. 元素分析仪 D. 核磁共振仪
同时满足下列条件的C的同分异构体有_____种(不考虑立体异构)。
①苯环上连有-NH2 ②能发生水解反应和银镜反应
(5)参照上述合成路线,设计以苯和丁酮( ![]() ) 为原料制备
) 为原料制备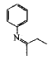 的合成路线(无机试剂任选):________________________________。
的合成路线(无机试剂任选):________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】青铜是人类历史上一项重大发明,它是铜(Cu)、锡(Sn) 和铅(Pb) 的合金,也是金属冶铸史上最早的合金 。 请回答 :
(1)基态Cu原子通过失去_____轨道电子转化为Cu+;Sn的原子序数为50,基态Sn原子的价层电子排布式为______。
(2)红氨酸(![]() ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___; N原子的杂化方式为___; N原子与 H原子形成共价键的电子云对称形式为___ 。
(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。
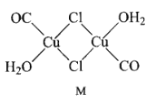
①与CO互为等电子体的离子为 _________(任写一种即可)。
②M中所有元素的电负性由大到小的顺序为 ____________。
③画图表示出M 中Cu原子形成的所有配位键_________。
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为___________。
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4 围成一个正四面体空隙 ,a2、a3、a4 、a5、a6、a7 围成一个正八面体空隙。
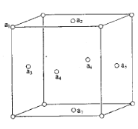
①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=____。
②若a2 与a3 的核间距离为d pm, 阿伏加德罗常数的值为NA,则铜晶体的密度为___gcm-3( 列出计算表达式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。

回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目: 来源: 题型:
【题目】为了解决能源的可再生及将CO2变废为宝等问题,科学家借鉴自然界的光合作用原理,通过“人工” 光合作用合成了甲醇等液态燃料,因此甲醇又被称为液态太阳燃料。液态太阳燃料的合成及应用如下图所示。 请回答:
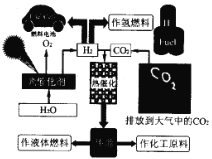
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;______;在图示转化过程中,太阳能除了储存在甲醇中,还储存在_____中(填化学式)。
(2)图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJmo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJmol-1
△H =_____________。
(3)实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
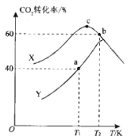
①该反应适宜选用的催化剂为__________(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=______;b、c点对应状态下反应物的有效碰撞几率b______c(填“>”“<”或“=”),原因为___________。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=_________。 (KP为用分压表示的平衡常数)。
(4)我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“”标出,过渡态用TS表示。
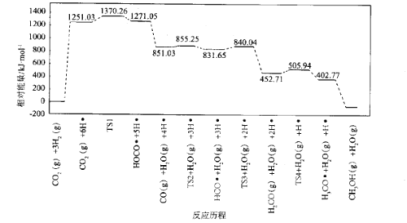
四个过渡态中对反应速率影响最大的是____,理由为____;该步骤的化学方程式为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中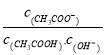 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目: 来源: 题型:
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅 B. H2、I2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,降温或加压有利于氨的合成 D. 红棕色NO2加压后颜色先变深后变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 NaOH溶液滴定NH4HSO4溶液 ,混合溶液的相对导电能力变化曲线如图所示,已知: Kb(NH3 H2O) =10-5,下列叙述正确的是
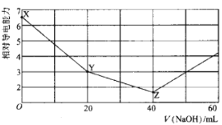
A.X→Y 过程中发生反应的离子方程式为:![]() +OH-= NH3 H2O
+OH-= NH3 H2O
B.Y点满足:c(![]() ) +c(Na+) =2c(
) +c(Na+) =2c(![]() )
)
C.水的电离程度:X>Y>Z
D.若Z点溶液pH=1l,则此时溶液中氨水浓度约为0.1 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物甲是一种重要的医药中间体,其结构式如图所示。其中Q、W、X、Y、Z为原子半径依次递增的短周期元素,Q、X、Z分列于三个不同周期。下列说法错误的是
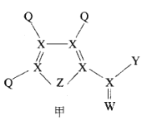
A.非金属性:X<Z<W
B.Q与W形成化合物的沸点高于Q与X形成化合物的沸点
C.化合物甲中除Q外,其它原子均满足8电子稳定结构
D.0.1 molL-1 最高价氧化物对应水化物的酸性:Y> Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com