
科目: 来源: 题型:
【题目】绿色化学的核心内容之一是“原子经济”,即反应物的原子全部转化为所期望的最终产物,原子利用率为100%.以下制备反应中最符合“原子经济”要求的是
A.甲烷与氯气制备一氯甲烷B.![]() 与消石灰反应制取漂白粉
与消石灰反应制取漂白粉
C.铜和浓硝酸反应制取硝酸铜D.CH3C![]() CH+CO+CH3OH
CH+CO+CH3OH![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物I是β—氨基酮类化合物。利用Michael加成反应合成I的路线如图,回答下列问题:
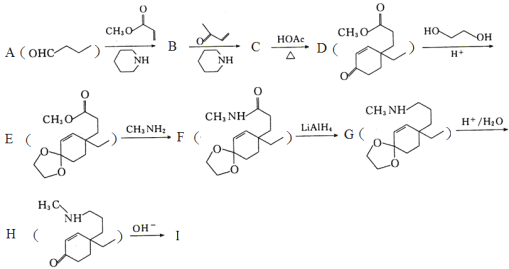
已知:①Michael加成反应通式为:A—CH2—R+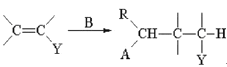 (A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、
(A,Y可以是CHO、C=O、COOR等;B可以是OH—、CH3CH2O—、![]() 等)
等)
②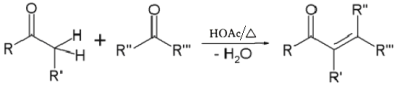
(1)A→B的化学方程式为___。
(2)化合物C和I的结构简式分别为___、___。
(3)B→C和E→F的反应类型分别是___、___。
(4)写出符合下列条件的D的同分异构体的结构简式___。
①与氢氧化钠完全反应时,二者物质的量之比为1:2;
②有4种不同化学环境的氢;
③能使FeCl3溶液显紫色。
(5)写出以苯甲醛、丙酸甲酯和![]() 为原料合成
为原料合成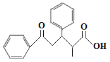 的合成路线___(其它试剂任选)
的合成路线___(其它试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) ![]() C2H5OH(l) ΔH=-44.2kJ·mol-1
C2H5OH(l) ΔH=-44.2kJ·mol-1
2CO2(g)+2H2O(l) ![]() C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
已知2CO2(g)+3H2O(l) ![]() C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
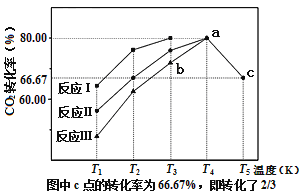
①催化剂效果最佳的反应是___(填“反应I”,“反应II”,“反应III”)。
②b点v(正)___v(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___。
④c点时该反应的平衡常数K=___。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
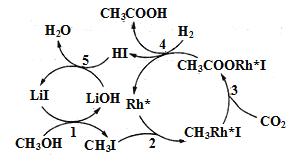
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化铈Ce(OH)4是一种重要的稀土氢氧化物,它可由氟碳酸铈矿(主要含CeFCO3)经如下流程获得:
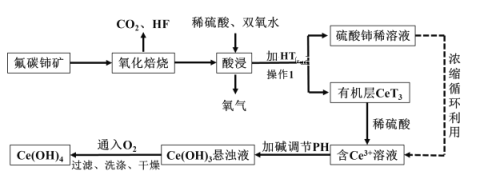
已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(1)氧化培烧时不能使用陶瓷容器,原因是_____________________________________。
(2)氧化焙烧生成的铈化合物二氧化铈(CeO2),其在酸浸时反应的离子方程式为___________;
(3)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(4)取某Ce(OH)4产品0.50g,加硫酸溶解后,与23.00mL0.1000mol/L的FeSO4溶液恰好完全反应(铈被还原成Ce3+).(已知:Ce(OH)4的相对分子质量为208)
①FeSO4在该反应中作________剂(填“氧化”或“还原”);
②计算Ce(OH)4产品的纯度____________;
③若用硫酸酸化后改用0.1000mol/L的FeCl2溶液滴定产品从而测定Ce(OH)4产品的纯度,其它操作都正确,则测定的Ce(OH)4产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
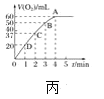
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
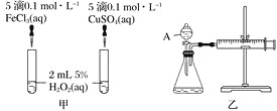
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
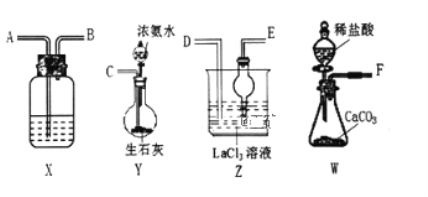
(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;__________
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入NH3,后通入过量的CO2,原因为__________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】把0.4molX气体和0.6molY气体混合于2L密闭容器中,使它们发生如下反应:4X(g)+5Y(g) ![]() nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
nZ(g)+6W(g)。2min末已生成0.3molW,若测知以Z的浓度变化表示的反应速率为0.05mol/(L·min),试计算
(1)前2min内用W的浓度变化表示的平均反应速率为_______________。
(2)2min末时Y的浓度为_____________________________。
(3)化学反应方程式中n=_____________________________。
(4)2min末,恢复到反应前温度,体系内压强是反应前压强的__________倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】用粗制ZnO粉末(含杂质Fe、Ni等)制备高纯ZnO的流程如下:
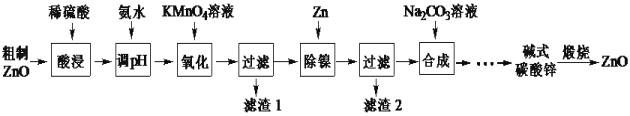
已知:本实验条件下,Ni2+不能被氧化,高锰酸钾还原产物为MnO2;过滤出滤渣1达到除铁目的。
(1)加快酸浸速率可采取的措施_____________________________。(任写一条)
(2)写出“除镍”步骤发生的主要反应离子方程式____________________________。
(3)“滤渣2”的成分是______。
(4)流程中“![]() ”涉及的操作有______、洗涤、______。
”涉及的操作有______、洗涤、______。
(5)获得的碱式碳酸锌需要用水洗涤,检验沉淀是否洗涤干净的方法是_____。
(6)若碱式碳酸锌的成分是ZnCO3· xZn(OH)2。取干燥后的碱式碳酸锌11.2g,煅烧后可得到产品8.1g,则x等于______。
查看答案和解析>>
科目: 来源: 题型:
【题目】多年来,储氢材料、光催化剂与硼酸盐材料的研究一直是材料领域的热点研究方向。回答下列问题:
一种Ru络合物与g-C3N4符合光催化剂将CO2还原为HCOOH的原理如图。
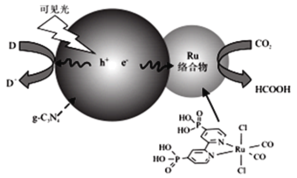
(1)Ru络合物中第二周期元素的第一电离能由大到小的顺序为___,Ru络合物含有的片段![]() 和
和![]() 中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
中都存在大π键,氮原子的杂化方式为___,氮原子配位能力更强的是___(填结构简式)
(2)基态碳原子的价电子排布图为___,HCOOH的沸点比CO2高的原因是___。
(3)2019年8月13日中国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为____,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___。
a.π键 b.σ键 c.配位键 d.极性键
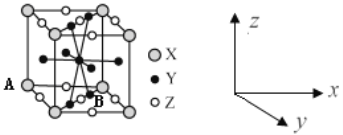
(4)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为___(填化学式)。若原子分数坐标A为(0,0,0),则B(Y)的原子分数坐标为___,已知LaNi5H6摩尔质量为499g·mol-1,晶体密度为g·cm-3,设NA为阿伏加德罗常数的值,则晶胞参数为a=___pm(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com