
科目: 来源: 题型:
【题目】(1)用惰性电极电解下列溶液,写出电极反应式和总反应式以及溶液复原需加入的物质
①NaCl溶液
阴极:_________;阳极:_________;总反应式:_______________;溶液复原需加入的物质____________。
②CuSO4溶液
阴极:_________;阳极:______;总反应式:____________________________;溶液复原需加入的物质____________。
(2)写出下列原电池电极反应式和总反应式
①氢氧燃料电池(电解质是KOH溶液)
负极反应:______________________;
正极反应:__________________;
总反应:_____________。
②甲烷燃料电池。碱性介质(如KOH)
负极:____________;
正极:______________;
总反应式:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①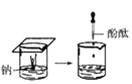 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②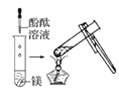 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③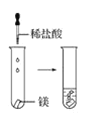 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④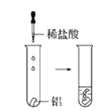 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学学习了同周期元素性质的递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象,如下表。

请你帮助该同学整理并完成实验报告。
(1)实验目的:__________________。
(2)实验仪器:①________;②________;③________;④试管夹;⑤镊子;⑥小刀;⑦玻璃片;⑧砂纸;⑨胶头滴管等。
(3)实验药品:钠、镁带、铝条、2 mol·L-1盐酸、新制的氯水、硫化氢饱和溶液、氯化铝溶液、氢氧化钠溶液等。
(4)请你写出上述的实验操作对应的现象(用A~F表示):
①________;②________;③________;④________;⑤________;⑥________。
(5)写出实验操作②、⑥中有关反应的离子方程式:
实验②________________________,实验⑥______________________。
(6)实验结论:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙可以用于改善地表水质,处理含重金属元素废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如图:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是___。
(2)检验“水洗”操作滤液中是否含Cl-,的正确操作是___。
(3)沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①___;②___。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,
再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液
VmL。(已知:I2+2S2O32-=2I-+S4O62-)
①CaO2的质量分数为___(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能___(填“不变”、“偏低”或“偏高”),原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在相同容积的4个密闭器中进行同一种可逆反应,2A(g)+B(g)![]() 3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示。各容器所盛物质的量在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是
3C(g)+2D(g),起始时4个容器所盛A、B的量如下表所示。各容器所盛物质的量在相同温度下,建立平衡时,4个容器中A或B的转化率的大小关系是

A.A的转化率为:甲<丙<乙<丁
B.A的转化率为:甲<乙<丙<丁
C.B的转化率为:甲>丙>乙>丁
D.B的转化率为:丁>乙>丙>甲
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
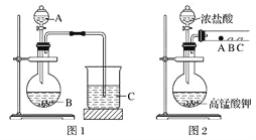
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列8种化学符号:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。
。
(1)表示核素的符号共______种。
(2)互为同位素的是________________。
(3)质量相同的H216O和D216O所含中子数之比为________。
根据周期表对角线规则,金属Be与Al单质及其化合物性质相似。试回答下列问题:
(4)写出Be与NaOH溶液反应生成Na2[Be(OH)4]的离子方程式:__________________
(5)Be(OH)2与Mg(OH)2可用____________________试剂鉴别。
查看答案和解析>>
科目: 来源: 题型:
【题目】“瑞德西韦(Remdesivir)”对新型冠状病毒(SARS-CoV-2)有明显的抑制作用,其合成路线如下:
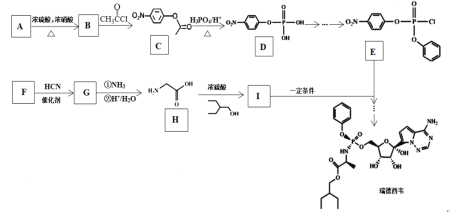
已知:![]()
(1)有机物G中官能团名称是________、_________。
(2)有机物H的化学名称为____________。
(3)A到B的反应类型是___________。
(4)有机物F的结构简式是__________。
(5)写出由B到C的反应方程式_________________。
(6)有机物M是C的一种同分异构体,满足下列条件的同分异构体有___种;其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为____________。
①苯环上有3个取代基 ②能发生银镜反应
③不能与FeCl3发生显色反应 ④能发生水解反应,且1 mol M消耗4 mol NaOH
(7)设计由苯甲醇为原料制备化合物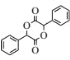 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com