
科目: 来源: 题型:
【题目】化合物M是一种香料,可采用油脂与芳香烃(含苯环的烃)为主要原料,按下列路线合成:
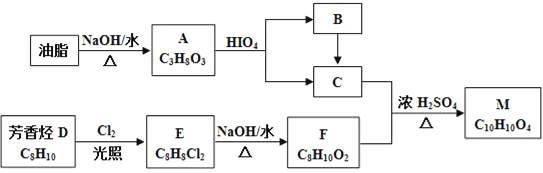
已知:①RX![]() ROH
ROH
②E分子中只有两种不同化学环境的H原子
③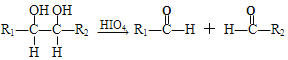
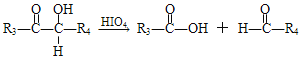
(R1、R2、R3与R4可能是氢、烃基或其他基团)
(1)A中官能团的名称是___,D→E的反应类型为___。
(2)E的结构简式为___。
(3)C+F→M的化学方程式____。
(4)下列化合物中属于F的同分异构体的是____。
a.![]()
b.![]()
c.![]()
d.CH2=CH﹣CH=CH﹣CH=CH﹣CH2COOH
(5)写出从Br﹣CH2CH2﹣Br→HCOOCH2CH2OOCH的合成路线(无机试剂任选,合成路线参照题中的书写形式)____。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程如图:
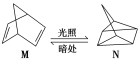 ΔH=+88.6 kJ/mol,
ΔH=+88.6 kJ/mol,
则M、N相比,较稳定的是_____(用字母“M”或“N”表示)。
(2)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(g)+O2(g)=CO2(g)+2H2O(l) ΔH=-a kJ/mol,则a_____238.6(填“>”“<”或“=”)。
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g),已知升高温度CO的浓度增大。
Si3N4(s)+6CO(g),已知升高温度CO的浓度增大。
①该反应的焓变ΔH______(填“>”“<”或“=”)0;
②降低温度,其平衡常数值将______(填“增大”“减小”或“不变”);
③增大压强,N2的体积分数将_____(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式碳酸镍[Nix(OH)y(CO3)z·nH2O]是一种绿色晶体,常用作催化剂和陶瓷着色剂,为确定其组成,某小组进行了实验探究。
(查阅资料)碱式碳酸镍300℃以上时分解生成3种氧化物。NiO为绿色粉末,Ni2O3为灰黑色固体。
(实验探究)选用下图所示部分装置进行实验(夹持装置略)
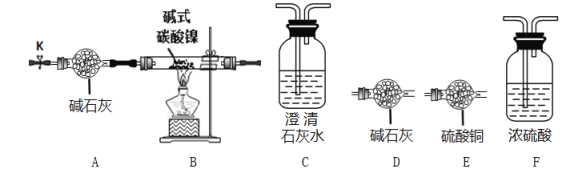
实验I定性探究:确定3种氧化物的组成。
(1)预测三种氧化物分别是含Ni、H、、C三种元素的理论依据是___________________。
(2)经检验生成的三种氧化物分别为NiO、H2O和CO2,装置连接顺序为AB__________(填装置的字母序号)。其中装置B现象为_________________。
实验II 定量确定碱式碳酸镍的组成。连接装置A-B-F-D-D进行实验。
实验步骤如下:
i 称量碱式碳酸镍、装置F、装置D(前一个)的质量并记录
ii 打开活塞K,缓缓通入空气
iii点燃酒精灯,加热
iv熄灭酒精灯, 冷却到室温, 关闭K
v 再次称量装置F、装置D(前一个)的质量并记录
(3)其中步骤ii的目的是_____________________________________。
(4)若缺少装置A将导致所测得的x值___________(填“偏大”或“偏小”或“无影响”)。
(5)重复操作ii-v至__________________________时,可判断碱式碳酸镍已完全分解。
(6)实验前测得石英玻璃管中的样品质量为3.77g,其他数据如下表所示
装置F质量/g | 装置D(前一个)质量/g | |
实验前 | 132.00 | 41.00 |
实验后 | 133.08 | 41.44 |
该碱式碳酸镍的化学式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知亚磷酸(H3PO3)的结构如图,
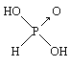
是具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____。亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为____。
(2)某温度下,0.1mol/L的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol/L该温度下H3PO3的一级电离平衡常数![]() =____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:
=____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:![]() ____
____![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应X(g)+Y(g) ![]() nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
nZ(g) ΔH >0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是( )
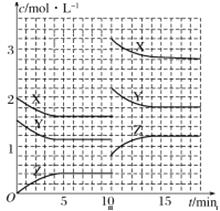
A.反应方程式中n=1
B.10min时,曲线发生变化的原因是升高温度
C.10min时,曲线发生变化的原因是增大压强
D.前5min后,用X表示的反应速率为v(X)=0.08mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,将1molPCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) ![]() PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是( )
PCl3(g) + Cl2(g),反应达到平衡时,测得PCl5为0.4mol,此时再向容器中通入1mol PCl5,同样温度下再达到平衡时,测得PCl5为amol,下列判断正确的是( )
A.Cl2的体积分数增大B.PCl5的转化率增大
C.a =0.8D.a > 0.8
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子.在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2XCl+2CO+2H2O═X2Cl22CO2H2O
(1)X基态原子的电子排布式为______.
(2)C、H、O三种原子的电负性由大到小的顺序为______.
(3)X2Cl22CO2H2O是一种配合物,其结构如图1所示:
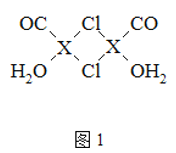
①与CO为互为等电子体的分子是______.
②该配合物中氯原子的杂化方式为______.
③在X2Cl22CO2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键______.
(4)XCl的晶胞如2图所示,距离每个X+最近的Cl-的个数为______.XCl的化学式__________
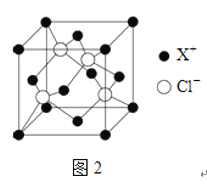
已知X的半径为apm,此晶胞的密度为dg/cm3,则阿伏加德罗常数NA=_____________(无需化简,列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com