
科目: 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。
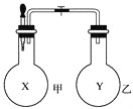
该同学在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的氢氧化钠溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是氯化氢、氨气、氯气、氧气、甲烷、二氧化硫、一氧化氮七种气体中的两种,则下列判断中,正确的是( )
A. X是氨气,Y是氯化氢 B. X是氯气,Y是甲烷
C. X是二氧化硫,Y是氧气 D. X是一氧化氮,Y是氧气
查看答案和解析>>
科目: 来源: 题型:
【题目】下表中列出了25 ℃、101 kPa时一些物质的燃烧热数据:
物质 | CH4(g) | CH3OCH3(g) | H2(g) | HC≡CH(g) |
燃烧热/(kJ·mol-1) | 890.3 | 1 453.0 | 285.8 | 1 299.6 |
已知:①1 mol液态水变为气态水要吸收44.0 kJ的热量;
②键能:C—H键 413.4 kJ·mol-1、H—H键 436.0 kJ·mol-1。
下列叙述错误的是
A. CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-1 453.0 kJ·mol-1
B. C≡C键的键能为786.0 kJ·mol-1
C. 2CH4(g)+O2(g)=CH3OCH3(g)+H2O(g) ΔH=-283.6 kJ·mol-1
D. H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)若1.92 g Cu粉与一定量浓HNO3反应,当Cu完全反应时,收集到标准状况下1.12L气体,则消耗硝酸________mol,生成NO2________mol;
(2)若向Cu中加入硫酸和硝酸的混酸溶液制取CuSO4溶液,则混酸中硫酸与硝酸的最佳物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2,6-二甲基苯氧乙酸是合成抗新型冠状病毒药物洛匹那韦的原料之一,其结构简式如图所示,有关2,6-二甲基苯氧乙酸说法正确的是( )
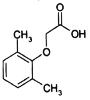
A.该分子所有原子可能处于同一平面B.该分子苯环上一氯代物有3种
C.该分子能使酸性高锰酸钾溶液褪色D.该分子与苯甲酸互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
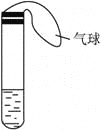
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、科技及环境密切相关。下列说法正确的是( )
A.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
B.白葡萄酒含维生素C等多种维生素,通常添加微量![]() 的目的是防止营养成分被氧化
的目的是防止营养成分被氧化
C.酒精与84消毒液混合,可增强杀灭新型冠状病毒效果
D.聚合硫酸铁![]() ,是新型絮凝剂,可用来杀灭水中病菌
,是新型絮凝剂,可用来杀灭水中病菌
查看答案和解析>>
科目: 来源: 题型:
【题目】P4S3是黄色或淡黄色结晶或粉末,无臭、无味、易燃、有毒,遇潮气发生分解,分子结构如图所示,已知其燃烧热ΔH=3 677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
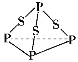
A.分子中磷元素显+3价
B.分子中每个原子最外层均达到8电子稳定结构
C.热化学方程式为P4S3(s)+8O2(g) ===P4O10(s)+3SO2(g) ΔH=3 677 kJ/mol
D.分子中存在极性键与非极性键
查看答案和解析>>
科目: 来源: 题型:
【题目】四氯化钛是制取海绵钛和氯化法钛白(二氧化钛)的主要原料,用于制造颜料和钛有机化合物以及国防上用的烟幕剂。同时也是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3,含有少量Fe2O3、SiO2、Al2O3等杂质),制备TiCl4等产品的一种工艺流程如下:

已知:
Ⅰ.①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe===3Fe2+、2TiO2+(无色)+Fe+4H+===2Ti3+(紫色)+Fe2++2H2O、Ti3+(紫色)+ Fe3++ H2O===2TiO2+(无色)+ Fe2++2H+;
Ⅱ.四氯化钛的熔点-25.0℃,沸点136.4℃,SiCl4的熔点-68.8℃,沸点57.6℃。
回答下列问题:
(1)用盐酸酸浸时,为使酸浸速率加快,可采取的措施是:________________(至少写2条),发生主要反应的离子方程式为:___________。
(2)废渣的成分是_______。
(3)如何检验富含TiO2+溶液中是否还含铁元素_____________。
(4)若将制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,该温度下反应![]() 的平衡常数K=____。
的平衡常数K=____。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_______(只要求写出一项)。
(6)要精制含少量SiCl4杂质的TiCl4,可采用的方法是_______。
(7)用TiCl4水解生成TiO2·nH2O,经过滤、水洗除去其中的Clˉ,再烘干、焙烧除去水分得到粉体TiO2.写出TiCl4水解生成TiO2·nH2O的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
4NO(g)+CO2(g)+2H2O(g) ΔH=574 kJ·mol1
②CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
2N2(g)+CO2(g)+2H2O(g) ΔH=1 160 kJ·mol1
下列说法不正确的是
A. 由反应①可推知:CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
4NO(g)+CO2(g)+2H2O(l) ΔH=Q,Q>574 kJ·mol1
B. 等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C. 若用标准状况下4.48 L CH4还原NO2至N2,则放出的热量为173.4 kJ
D. 若用标准状况下4.48 L CH4还原NO2至N2,则整个过程中转移的电子总物质的量为1.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com