
科目: 来源: 题型:
【题目】恒温、恒压下,1 mol A和1 mol B在一个容积可变的容器中发生如下反应:A(g)+2B(g) ![]() 2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
2C(g)。一段时间后达到平衡,生成a mol C。下列说法不正确的是
A. 起始时刻和达到平衡后容器中的压强比为1:1
B. 物质A、B的转化率之比一定是1:2
C. 若起始放入3 mol A和3 mol B,则达到平衡时生成3a mol C
D. 当v正(A)=v逆(B)时,可断定反应达到平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】“磷酸氯喹”是抗击新型冠状病毒的潜在药物,其合成路线如下:
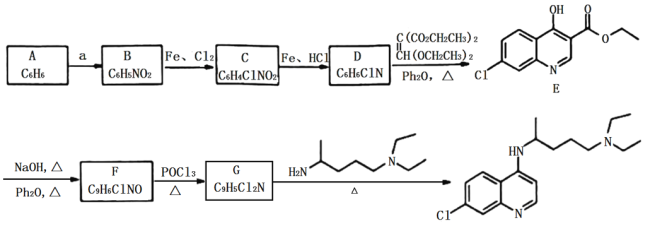
已知: 
![]()

(1)A是一种芳香烃,试剂a为:____________________。
(2)B反应生成C的反应化学方程式为____________________。
(3)由C生产D和由F生成G的反应类型分别为__________、___________。
(4)D的结构简式为_________。
(5)E中含氧官能团的名称为________。
(6)I与E互为同分异构体,且具有完全相同的官能团,符合下列条件的I有____种。(不考虑立体异构)
①分子结构中含有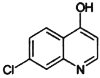 ;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。
;②分子中环状结构上只有三个取代基。写出其中任意两种结构简式____、______。
(7)有机物J(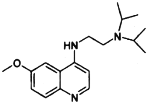 )是治疗血吸虫病的药物,参照上述
)是治疗血吸虫病的药物,参照上述![]() 的合成路线,设计由4-甲氧基苯氨(
的合成路线,设计由4-甲氧基苯氨( )和N,N-二异丙基乙二胺(
)和N,N-二异丙基乙二胺(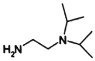 )为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。
)为起始原料制备有机J的合成路线_______________________(无机试剂任意选用)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O (相对分子质量为376)是一种氧气吸收剂,为红棕色晶体,潮湿时易被氧化,微溶于乙醇,不溶于水和乙醚(易挥发的有机溶剂)。其制备装置及步骤如下:
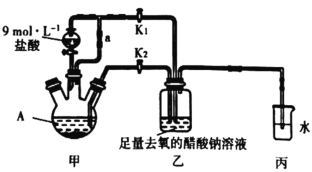
①________________________________________。
②往装置A中依次加入过量锌粒、适量CrCl3溶液。
③关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
④待A内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
⑤将装置乙中混合物快速过滤、洗涤和干燥,称量得到[Cr(CH3COO)2]22H2O。
(1)实验步骤①进行什么操作______________________________。
(2)装置A的名称__________________。
(3)写出装置A中反应的离子方程式为__________________,___________________________。
(4)实现步骤①中溶液自动转移至装置乙中的实验操作为__________________。
(5)步骤③目的是_____________________________________________。
(6)洗涤产品时,依次用去氧的冷蒸馏水、无水乙醇、乙醚,目的是__________________。
(7)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质12.68g,实验后得干燥纯净的[Cr(CH3COO)2]22H2O 11.28g,则该实验所得产品的产率为_______(不考虑溶解的醋酸亚铬水合物)(用百分数表示,保留3位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1molI2和2molH2(g)置于某2L密闭容器中,在—定温度下发生反应:I2(g)+H2(g)![]() 2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线
2HI(g) △H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线

(1)达平衡时,I2(g)的物质的量浓度为 _______。H2(g)的平衡转化率为___________。
在此温度下,该反应的平衡常数K__________(保留一位小数)。
(2)若改变反应条件下,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示。则甲条件可能是______(填入下列条件的序号。下同),乙条件可能是________。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2和c mol HI(a、b、 c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的应满足的关系是_______________ (用含一个a、b、c的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、S、P等元素常用于化工材料的合成。回答下列问题:
、S、P等元素常用于化工材料的合成。回答下列问题:
(1)钴原子的基态电子排布式为_______________________。
(2)![]() 有________几种不同的运动状态的电子,
有________几种不同的运动状态的电子,![]() 比
比![]() 更稳定的原因是_________。
更稳定的原因是_________。
(3)硒为第四周期元素,相邻元素有砷和溴,则三种元素的电负性从大到小的顺序为_________(用元素符号表示)。
(4)![]() 的熔点为340℃,加热易升华,固体
的熔点为340℃,加热易升华,固体![]() 属于______晶体。
属于______晶体。![]() 的空间构型为_____。
的空间构型为_____。
(5) ![]() 可用于制造火柴,其分子结构如图甲所示。
可用于制造火柴,其分子结构如图甲所示。![]() 分子中S的杂化方式为______。每个
分子中S的杂化方式为______。每个![]() 分子中含有的孤电子对的数目为_________。
分子中含有的孤电子对的数目为_________。


(6)铜的某种氧化物晶胞结构如图乙所示,该氧化物的化学式为____________。若该晶胞的边长为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,则该氧化物的密度为_________
,则该氧化物的密度为_________![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】含碳化合物在生产生活中广泛存在。请回答下列问题:
(1)Andren Dasic等提出在金属催化剂M的作用下以![]() 为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用
为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用![]() 表示),氧原子与
表示),氧原子与![]() 生成
生成![]() 的结合力
的结合力![]() ,氧原子与乙烯生成乙醛的结合力
,氧原子与乙烯生成乙醛的结合力![]() ,则可做该反应催化剂的金属M与氧原子的结合力
,则可做该反应催化剂的金属M与氧原子的结合力![]() (M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。
(M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。

(2)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() 、
、![]() 、
、![]() 。
。
则反应:![]() ΔH=_________。
ΔH=_________。
(3)已知在含少量的![]() 溶液中,反应
溶液中,反应![]() 分两步进行:第Ⅰ步反应
分两步进行:第Ⅰ步反应![]() (慢反应),第Ⅱ步为快反应。
(慢反应),第Ⅱ步为快反应。
①请写出第二步反应的化学方程式:____________。
②增大浓度![]() 浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
(4)某密闭容器中发生:![]() ,
,![]() 在不同温度下平衡分解的情况如图2所示。
在不同温度下平衡分解的情况如图2所示。


①图中a、b、c三点的平衡常数![]() 的大小关系为_____________。
的大小关系为_____________。
②恒温恒容条件下,能表示该可逆反应达到平衡状态的是____________(填标号)
A.![]() 体积分数与
体积分数与![]() 体积分数的比值保持不变
体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
③为实现![]() 减排,目前较成熟的方法是用高浓度的
减排,目前较成熟的方法是用高浓度的![]() 溶液吸收工业烟气中的
溶液吸收工业烟气中的![]() ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图3,简述
溶液再生,其装置示意图如图3,简述![]() 在阴极区再生的原理_______。
在阴极区再生的原理_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关氨的叙述中不正确的是( )
A. 氨分子中氮元素的化合价只能升高,氨具有还原性
B. 氨的催化氧化反应的化学方程式是4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
C. 氨的催化氧化反应中若氧气过量则有红棕色气体生成
D. 氨的催化氧化属于人工氮的固定
查看答案和解析>>
科目: 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com