
科目: 来源: 题型:
【题目】有原子序数依次增大的a、b、c、d四种元素,最外层电子数分别为4、1、x、7,已知c原子的电子层数等于x,d-的电子层结构与Ar元素相同。下列说法错误的是( )
A.元素a与氢形成原子比为1:1的化合物有多种
B.元素b的单质能与水、无水乙醇反应
C.c的简单离子与d-的简单离子最外层电子数和电子层数都不相同
D.元素a与元素d可形成既含有极性共价键又含非极性共价键的化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】复旦大学研发的一种新型水锂电池,一极采用复合膜包裹的金属锂,另一极采用锰酸锂(LiMn2O4),以0.5mol·L-1Li2SO4水溶液作电解质,安全性能和成本较现有的锂离子电池都具有明显的优势。下列有关该电池的说法不正确的是( )

A.电极a是负极,电极b是正极
B.工作时电池的总反应为:LiMn2O4+Li=Li2Mn2O4
C.放电时,溶液中Li+从a向b迁移
D.电池放电时的阳极反应式为:Li2Mn2O4e-=LiMn2O4+Li+
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中进行反应CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
CO(g)+3H2(g) △H>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
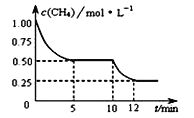
A. 10 min时,改变的外界条件可能是升高温度
B. 反应进行到12min时,CH4的转化率为25%
C. 0∽5 min内,v(H2)=0.1 mol·(L·min)-1
D. 恒温下,缩小容器体积,平衡后H2浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l) | |
步骤: | 现象: 待试管b中颜色不变后与试管a比较, 溶液颜色变浅。 滴加浓硫酸,试管c温度略有升高, 溶液颜色与试管a相比,变深。 |
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)![]() CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
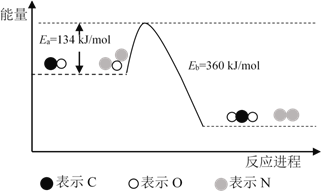
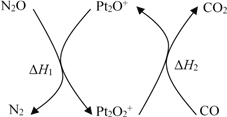
A. ΔH = ΔH1 + ΔH2
B. ΔH = 226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如图:
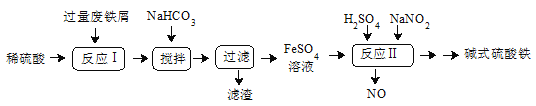
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.0 | 5.9 | 3.7 |
完全沉淀 | 3.5 | 8.4 | 4.7 |
请回答下列问题:
(1)该工艺中“搅拌”的作用是__,写出反应I中发生氧化还原反应的离子方程式__。
(2) “滤渣”的主要成分是__(填化学式),加入适量NaHCO3的目的是调节pH在__范围内。
(3)反应Ⅱ中加入NaNO2的离子方程式为__,在实际生产中,可以同时通入O2以减少NaNO2的用量,若参与反应的O2有5.6L(标况),则理论上相当于节约NaNO2(Mr=69)用量__g。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解为Fe2(OH)![]() 聚合离子,该水解反应的离子方程式为__。
聚合离子,该水解反应的离子方程式为__。
(5)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:取25.00mL溶液,稀释到250mL,准确量取20.00mL于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。已知:2Fe3++2I-==2Fe2++I2、2![]() +I2==2I-+
+I2==2I-+![]()
则溶液中铁元素的总含量为__g·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
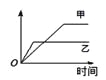
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实与对应的方程式不符合的是
A. 硫化氢溶液呈酸性:H2S ![]() 2H++S2–
2H++S2–
B. “NO2球”浸泡在冷水中,颜色变浅:2NO2(g) (红棕色) ![]() N2O4 (g) (无色) ΔH<0
N2O4 (g) (无色) ΔH<0
C. 甲烷的燃烧热ΔH=–890.3 kJ·mol–1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=–890.3 kJ·mol–1
D. 硫代硫酸钠溶液与稀硫酸混合出现浑浊:S2O32–+2H+=S +SO2 +H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】缓释布洛芬(即M: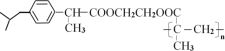 )是常用于解热镇痛药物。M的一种合成路线如图:
)是常用于解热镇痛药物。M的一种合成路线如图:
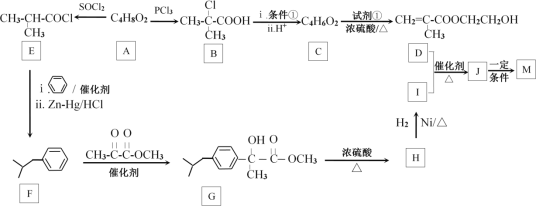
已知:RCOOR′+R″OH![]() RCOOR″+R′OH
RCOOR″+R′OH
请按要求回答下列问题:
⑴A系统命名的名称:__;反应条件①为__;C所含官能团的结构简式:__;试剂的分子式:__;J→M反应类型:__。
⑵A的同分异构体有多种,其中能发生银镜反应且含有羟基的有_种;写出其中核磁共振氢谱有3组峰,峰面积之比为6:1:1的结构简式__。
⑶写出D+I→J反应的化学方程式:__。
⑷以苯、![]() 、丙酮酸甲酯(
、丙酮酸甲酯(![]() )为起始原料制备有机物N(
)为起始原料制备有机物N(![]() ),写出N的合成路线___(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。
),写出N的合成路线___(其他试剂任选,合成路线示例见题干,有机物均写结构简式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com