
科目: 来源: 题型:
【题目】二甲醚(CH3OCH3)直接燃料电池具有启动快、效率高等优点,用二甲醚燃料电池电解甲基肼(CH3—NH—NH2)制氢的装置如图所示,其中X、Y、M、N均为惰性电极。下列说法正确的是( )
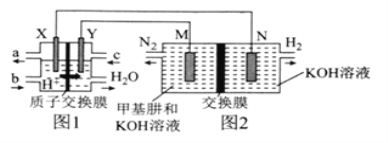
A.M极的电极反应式为CH3—NH—NH2+12OH--10e-=CO![]() +N2↑+9H2O
+N2↑+9H2O
B.图1中电解质溶液的pH减小,图2中电解质溶液的pH增大
C.图2中的交换膜是阴离子交换膜,OH-透过交换膜向N极移动
D.理论上,当生成6.72LH2时,消耗CH3OCH3的质量为2.3g
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 1.4gC2H4、C3H6 的混合气体中,所含碳原子总数为 0. lNA
B. 1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA
C. 标准状况下,22. 4LC2H6 中所含极性共价键的数目为 7NA
D. 50mL l2mol·L 的浓盐酸与足量 MnO2 反应,转移电子总数为 0. 3NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如图:
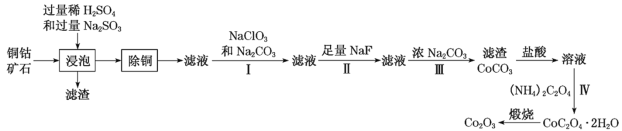
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的相关化学方程式:__。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=__。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3与Fe2+反应的离子方程式为__。
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(Co2+)为0.1molL-1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为__。[当c(Mn+)≤10–6molL–1,即认为该金属离子沉淀完全]
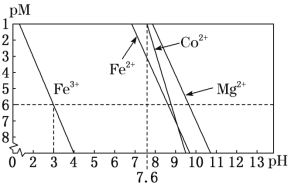
(4)步骤II中加入足量NaF的目的是__。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为__。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在某密闭容器中进行如下反应:

mA(g)+nB(g)![]() pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,
反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
A. 正反应是吸热反应 B. 逆反应是放热反应
C. m+n<p+q D. m+n>p+q
查看答案和解析>>
科目: 来源: 题型:
【题目】N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。
2NH3达到平衡,测得反应放出热量为Q1。
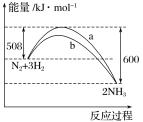
填写下列空白:
(1)Q1________92 kJ(填“>”“<”或“=”)。
(2)b曲线是________时的能量变化曲线。
(3)上述条件下达到平衡时H2的转化率为________。
(4)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
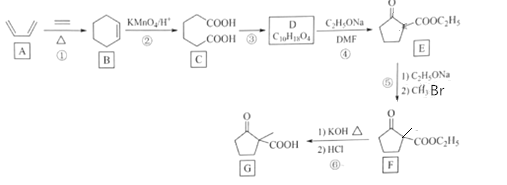
已知:R1CH2COOCH2CH3+R2COOCH2CH3![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是__。
(2)反应②和⑤的反应类型分别是__、__。
(3)写出C到D的反应方程式__。
(4)E的分子式__。
(5)F中官能团的名称是__。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式___。
(7)设计由乙酸乙酯和1,4-二溴丁烷制备 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰苯胺(C6H5-NHCOCH3)可用作止痛剂退热剂、防腐剂和染料中间体,常用苯胺(C6H5-NH2)与冰醋酸为原料制备,具体流程如下:
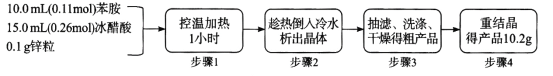
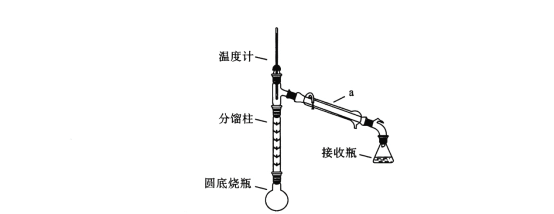
化学原理:C6H5-NH2 + CH3COOH![]() C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。
C6H5–NHCOCH3+ H2O,已知:①苯胺易被氧化,乙酰苯胺碱性条件下水解;②部分物质有关性质如下表;③步骤1所用装置如图所示(固定装置、加热装置已略去)。

请回答下列问题:
(1)仪器a的名称________________________
(2)盛有冰醋酸的容器,最有可能贴有的安全标签是__________(填标号)。
a.  b.
b.  c.
c. d.
d. 
(3)加入锌粒,除了防止暴沸外,还能起到的作用是________________
(4)步骤1中控制温度计示数约105 °C的原因是_____________________
(5)判断反应基本完全的现象是____________;步骤3中洗涤乙酰苯胺粗产品最合适的试剂是_________(填标号)。
a.冰水 b.热水 c.15%的乙醇溶液 d. NaOH溶液
(6)步骤4中重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→ _____ →冷却结晶→过滤→洗涤→干燥。
(7)本实验中乙酰苯胺产率为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质的量为0.10mol的镁条在只含有CO2和O2的容器中燃烧(产物不含碳酸镁,不考虑C与O2的反应),反应后容器内固体物质的质量不可能为( )
A.3.2g
B.4.0g
C.4.2g
D.4.7g
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.向体积为2 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:2X(g)![]() Y(g)+3Z(g)。经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的化学反应速率为____________,X的转化率为__________,Z的平衡浓度为_______________。
Y(g)+3Z(g)。经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则用Y表示的化学反应速率为____________,X的转化率为__________,Z的平衡浓度为_______________。
Ⅱ.一定温度下,反应N2(g)+O2(g)![]() 2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响(填“增大”“减小”或“不变”)。
(1)缩小体积使压强增大:__________;
(2)恒容充入N2:__________;
(3)恒容充入He:__________;
(4)恒压充入He:__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
A.加入催化剂有利于合成氨的反应
B.由 H2(g)、I2(g)和 HI(g)组成的平衡体系加压后颜色变深
C.500 ℃时比室温更有利于合成氨的反应
D.光照新制的氯水时,溶液的 pH 逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com