
科目: 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了用氧化浓盐酸的方法制取氯气的实验,其实验装置如下图:
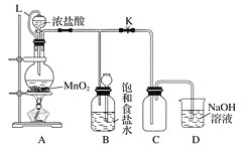
(1)写出圆底烧瓶中发生反应的化学方程式:___________________________________。
(2)如果将过量的二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要的原因有①______________________;②_________________。
(3)L的作用是____________________;B的作用是_________________。
(4)为了提高浓盐酸的利用率,你对实验的建议是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室制取SO2并验证SO2的某些性质的装置,请回答:

(1)在⑥中发生反应的化学方程式为______________________________________。
(2)①中的实验现象为石蕊溶液____________,此实验证明SO2具有____________的性质。
(3)②中的品红溶液________,证明SO2有________性。
(4)③中的实验现象是________________________,证明SO2有____________性。
(5)④中的实验现象是______,证明SO2有______性。
(6)⑤的作用是____________,反应的化学方程式为____________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A. 实验①中,若5min时测得n(M) =0.05mol,则0至5min时间内,用N表示的平均反应速率v(N) =0.01 mol/( L·min)
B. 实验②中,该反应的平衡常数K= 1.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴是一种重要的化工材料,广泛应用于有机合成。一种以铜钴矿(主要成分为Co2CuS4,一定量CuFeS2)为原料,生产草酸钴晶体(CoC2O4·2H2O)的工艺流程:
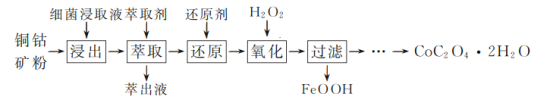
已知:①“浸出”液含有的离子主要有H+、Fe3+、Cu2+、Co3+、![]() ;
;
②pH增大,Fe2+被氧化的速率加快,同时生成的Fe3+水解形成更多的胶体;
③草酸钴晶体难溶于水;25℃时,Ksp[Co(OH)2]=1.6×10-15。
回答下列问题:
(1)生产时为提高铜钴矿粉浸出率,常采取的措施有________(填字母)。
a.适当延长浸出时间b.高温浸出c.分批加入细菌浸取液并搅拌
(2)“萃取”步骤中萃取除去的主要金属阳离子是________。
(3)“氧化”过程中,控制70℃、pH=4条件下进行,pH对除铁率和钴回收率的影响如图所示。
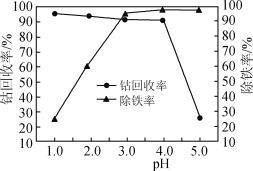
①用电子式表示H2O2的形成过程________。
②“氧化”过程的离子方程式为________。
③pH为4~5时,钴的回收率降低的原因是________。
(4)“过滤”后的滤液中加入(NH4)2C2O4溶液反应得到草酸钴晶体,过滤得到的草酸钴晶体需要用蒸馏水洗涤,检验晶体是否洗涤干净的方法是_______________。
(5)300℃时,在空气中煅烧CoC2O4·2H2O可制得Co3O4,该反应的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L恒容密闭容器中充入2molX和1molY,发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是( )
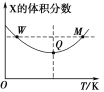
A.Q点时,Y的转化率最大
B.升高温度,平衡常数增大
C.W点X的正反应速率等于M点X的正反应速率
D.平衡时,再充入Z,达到平衡时Z的体积分数一定增大
查看答案和解析>>
科目: 来源: 题型:
【题目】聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2,经氧化、水解、聚合等步骤,可制备PFC。
(1)在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为______; Fe2+在酸性条件下被O2氧化的离子方程式为_______。

(2)盐基度[B=![]() × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响______。(填“越大”、“越小”或“无影响”)
(3)PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL1,样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com