
科目: 来源: 题型:
【题目】炼制石油能得到许多有机化合物,相关物质的转化关系如下图所示,其中A的产量是衡量一个国家石油化工发展水平的重要标志,标况下,B气体的密度为0.71gL-1,C是一种红色固体单质,D是一种混合气体。

请回答:
(1)A的结构简式为______,A与溴的四氯化碳溶液的反应类型为______。
(2)B与CuO反应的化学方程式______。
(3)下列说法不正确是______。
A.A中所有原子共平面
B.A与溴的四氯化碳溶液反应现象,和A与溴水反应的现象完全相同
C.等物质的量A与B混合物在足量氧气中完全燃烧,生成水的物质的量相等
D.B是引起温室效应的气体之一
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验乙烯性质的实验,请回答下列问题:
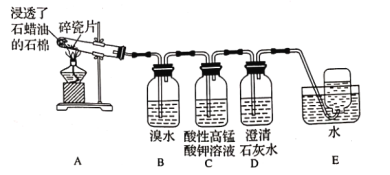
(1)A中碎瓷片的作用是________。
(2)B装置中反应的化学方程式为__________。
(3)C装置中可观察到的现象是_________。
(4)查阅资料.乙烯与酸性高锰酸钾溶液反应产生二氧化碳,根据本实验中装置_____(填装置字母)中的实验现象可判断该资料是否直实。
(5)通过上述实验探究,检验甲烷和乙烯的方法是_______(填字母,下同),除去甲烷中乙烯的方法是___。
A 气体通入水中 B 气体通过盛溴水的洗气瓶
C 气体通过盛酸性高锰酸钾溶液的洗气瓶 D 气体通过氢氧化钠溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算中和热.
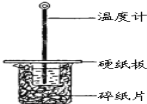
(1)下列说法不正确的是( )
A.该实验也可在保温杯中进行
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是保温、隔热,减少热量损失
D.若将盐酸体积改为60mL,两次实验所求得中和热不相等
(2)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是_________
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
C.量取NaOH溶液的体积时仰视读数
D.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(3)将一定量的稀氨水、稀氢氧化钠溶液、稀氢氧化钡溶液分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________;

(4)若将V1mL1.0molL-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).由图2可知,氢氧化钠的浓度为 __________ ;
查看答案和解析>>
科目: 来源: 题型:
【题目】为证明乙烯能被酸性KMnO4溶液氧化,某小组按下图装置制备乙烯并检验其化学性质。完成下列填空:
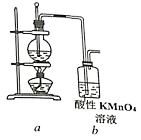
(1)首先检验该装置气密性。检验气密性的操作是:_____________。
(2)向圆底烧瓶中加入药品的顺序是:先加入_____,再缓慢加入____,最后再加入几粒碎瓷片。
(3)加热圆底烧瓶,使温度迅速上升到________℃,观察到烧瓶中的无色液体逐渐变黑。该黑色的物质是_______。
(4)酸性KMnO4溶液很快褪色,但不能说明乙烯具有还原性。理由是:_______________。
(5)选用下列装置(可重复使用也可不用)来证明乙烯具有还原性,请将装置按编号依次排列,并在装置序号对应位置的下一行写出装置内所放的药品。
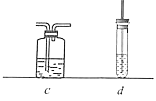
装置a→_____________________________→b。
药品:(a药品略)_________________________(b酸性KMnO4溶液)。
(6)若将b中酸性KMnO4溶液换成溴水,溴水也能褪色且可观察到b底部有少量无色油状液体生成,如何通过实验证明该无色油状液体中含有溴元素?______。如何通过实验证明乙烯和溴水发生的是加成反应而不是取代反应?____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)烃是一类重要的有机化合物,其结构与性质密切相关。
①下列有机化合物与甲烷互为同系物的是______(填字母)。
a.乙烯 b.乙烷 c.乙炔
②下列试剂可用于鉴别乙烷和乙烯的是______(填字母)。
a.水 b.四氯化碳 c.酸性KMnO4溶液
③下列有机化合物易溶于水的是________。
a..苯 b.乙烷 c.乙醇
(2) CH2=CH2、![]() 、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
、CH3CH2OH、CH3COOCH2CH3、CH3COOH、葡萄糖,其中:
①能通过化学反应使溴水褪色的是____________。
②能发生水解反应的是____________。
③能与新制Cu(OH)2悬浊液反应生成砖红色沉淀的是____________。
④能与Na2CO3溶液反应有气体生成的是__________。
(3)以淀粉为主要原料合成一种具有果香味的物质C合成路线如图所示。
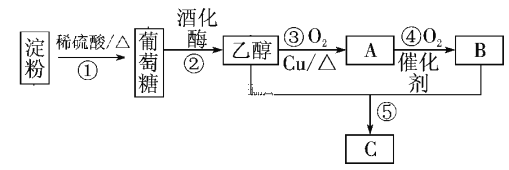
请回答下列问题:
(i) A的结构简式为____________,B分子中的官能团名称为________。
(ii)上述①~⑤的反应中,属于取代反应的有___________。(填序号)
(iii) 写出下列转化的化学方程式:
反应①____________________________;
反应⑤___________________________;
(4)乙烯是石油化工的重要基础原料,工业上可由乙烯与水反应制乙醇,该反应类型为_______,其化学方程式为___________________;乙烯还可通过加聚反应获得高分子材料聚乙烯,化学方程式为____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱土金属(ⅡA族)元素单质及其相关化合物的性质、合成一直以来是化学界研究的重点。回答下列问题:
(1)对于碱土金属元素Be、Mg、Ca、Sr、Ba,随着原子序数的增加,以下性质呈单调递减变化的是___。
A.原子半径 B.单质的硬度 C.第一电离能
(2)①铍与相邻主族的___ 元素性质相似。下列有关铍和该元素的叙述正确的有___填标号。
A.都属于p区主族元素
B.电负性都比镁大
C.第一电离能都比镁大
D.氯化物的水溶液pH均小于7
②(NH4)2BeF4是工业制备金属铍过程中的重要中间产物,其阳离子含有的化学键类型为__,阴离子中心原子杂化方式为___。
(3)Sr是人体必需的微量元素,SrCO3是其重要的化合物之一。Sr2+的电子排布式为___判断SrCO3的热分解温度___(填“大于”/“小于”)CaCO3的热分解温度,理由是____。
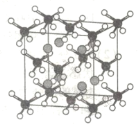
(4)MgH2和金属Ni在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的储氢化合物,其立方晶胞结构如图所示:
①Mg原子周围距离最近且相等的Ni原子有___个,若晶胞边长为646pm,则Mg—Ni核间距为___pm(结果保留小数点后两位,![]() 取1.73)。
取1.73)。
②若以晶胞中氢的密度与液态氢密度之比定义储氢材料的储氢能力,则该化合物的储氢能力为___(列出计算式即可。假定该化合物中所有的H可以全部放出,液氢密度为dg/cm3;设NA代表阿伏伽德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛(HCHO)是一种重要的化工产品,工业上可用甲醇脱氢法制备,相关反应方程式为:CH3OH(g) ![]() HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
HCHO(g)+H2(g) △H=+akJ/mol回答下列问题:
(1)反应过程中需要向体系中通入空气,通过以下反应提供上述反应所需要的热量:H2(g)+![]() O2(g)=H2O(g) △H=-bkJ/mol
O2(g)=H2O(g) △H=-bkJ/mol
要使反应温度维持在650℃,则进料时,甲醇和空气的体积比应为___(已知空气中氧气的体积分数为20%,b>a)。
(2)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH30H→H+CH2OH(H叫做氢自由基,实际上就是H原子,有很高的反应活性,
“”代表有一个单电子可以参与配对成键)
历程ii:CH2OH→H+HCHO
历程iii:CH2OH→3H+CO
历程iv:自由基发生碰撞形成新化学键而湮灭
如图1所示为在体积为2L的恒容容器中,投入1molCH3OH(g),在碳酸钠催化剂作用下开始反应,20min后,测得甲醇的转化率(X)与甲醛的选择性(S)与温度的关系(副反应仅考虑CH3OH![]() CO+2H2):
CO+2H2):
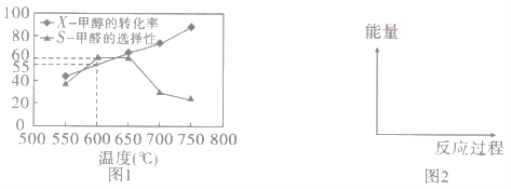
①请在图2所给坐标中,画出历程iv的反应过程一能量变化示意图___。
②下列说法合理的是__。
a.升高温度,甲醇转化率提高,平衡常数变大
b.当体系气体密度保持不变时,达到平衡状态
c.及时分离产品有利于提高甲醇生成甲醛的转化率
③600℃时,前20min甲醇的平均反应速率为__,此时生成甲醛的反应的Qp=___(Qp的表达式与平衡常数Kp相同,p为物质的分压,分压=总压×物质的量分数,体系初始压强为P0)
④650℃以后,甲醛的选择性降低,而甲醇的转化率升高的可能原因是___。
(3)氧化剂可处理甲醛污染,结合以下图像分析夏季(水温约20℃)应急处理甲醛污染的水源最好应选择的试剂为____。

查看答案和解析>>
科目: 来源: 题型:
【题目】W、X、Y、Z、M均为短周期元素且原子序数依次增大,W和X同族。Y原子最外层电子数是W与X原子最外层电子数之和的3倍,是Z原子最外层电子数的2倍,M的最高正价与最低负价代数和为6。下列说法正确的是
A.离子半径:W-<X+
B.化合物XZW4的结构如图所示,且有还原性

C.工业上可以用电解Z、M的熔融态化合物制备Z单质
D.W与Y形成的化合物均不能使品红溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com