
科目: 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素。
下列判断错误的是
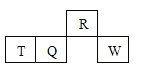
A. 原子半径:T > Q
B. 元素非金属性:Q > R
C. 气态氢化物的热稳定性:R>Q
D. 最高价氧化物对应水化物的酸性: W > Q
查看答案和解析>>
科目: 来源: 题型:
【题目】Zn与硝酸反应时,硝酸溶液的浓度不同,产物也不相同。与不同浓度硝酸反应时,反应的Zn与被还原硝酸的物质的量关系如图。还原产物为NH4NO3的曲线是( )
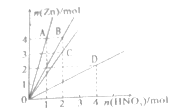
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】元素X、Y、Z 位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
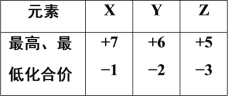
A.原子序数:X>Y>Z
B.原子半径:X>Y>Z
C.稳定性:HX>H2Y>ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、量筒、0.5 mol·L-1盐酸、0.55 mol·L-1氢氧化钠溶液,实验尚缺少的玻璃用品是___、___。
(2)他们记录的实验数据如下:
实验用品 | 溶液温度 | 中和热 | |||
t1 | t2 | ΔH | |||
a | 50mL 0.55mol·L-1NaOH溶液 | 50mL0.5mol·L-1HCl溶液 | 20℃ | 23.3℃ | ___ |
b | 50 mL0.55mol·L-1 NaOH溶液 | 50mL0.5mol·L-1 HCl溶液 | 20℃ | 23.5℃ | |
已知:反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1g·cm-3。计算完成表中ΔH=___。
(3)___(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法错误的是( )
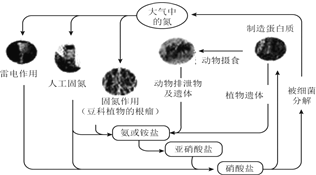
A.碳、氢、氧三中元素也参加了氮循环
B.含氮的无机物和含氮的有机物可以相互转化
C.仿生固氮和根瘤菌固氮均为天然固氮
D.氮元素有的发生氧化反应,有的发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生用如图所示装置制取氯气,并收集氯气进行实验。
请完成下列问题:
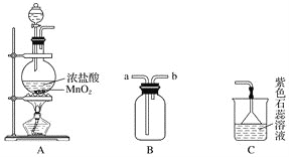
(1)装置A中发生反应的离子方程式为______________________________________。
(2)装置B如图中所示正放,则连接A的接口是________(填序号)。
(3)实验中可观察到装置C中紫色石蕊溶液的现象是__________________,其原因______________________________________________________________________。
(4)取出B中的集气瓶进行氯气与铜的反应实验,应该进行的操作是______________,然后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为__________(填“需要”或“不需要”)放,理由是____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产、生活、科技等密切相关,下列说法错误的是( )
A.开发利用太阳能、风能和氢能等新能源代替化石能源,利于实现低碳经济
B.利用膜材料将含油污水中的油水分离,发生的是化学变化
C.依照Cu![]() CuO
CuO![]() Cu(NO3)2的反应制取Cu(NO3)2符合不易产生污染的绿色化学理念
Cu(NO3)2的反应制取Cu(NO3)2符合不易产生污染的绿色化学理念
D.屠呦呦从青蒿中提取青蒿素对治疗疟疾有特效
查看答案和解析>>
科目: 来源: 题型:
【题目】反应:aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如图所示:
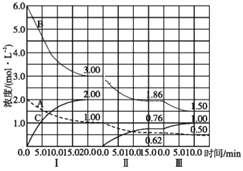
回答下列问题:
(1)反应的化学方程式中,a∶b∶c为___;
(2)B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是___;
(3)由第一次平衡到第二次平衡,平衡移动的方向是___,采取的措施是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
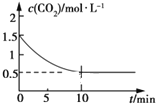
①该条件下反应的平衡常数为___;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为___mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填序号)。
增大的是___(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com