
科目: 来源: 题型:
【题目】分类是学习的一种重要方法,“价一类”二维图对学习化学知识具有重要的指导意义。物质的化学反应常与外界条件密切相关。回答下列问题:
(1)含有同一元素的X、Y、Z、E、M五种物质,一定条件下有以下的转化关系。
![]()
①若E为红棕色气体,则该气体的收集方法为___;X分子含有10个电子,则气体X水溶液中离子有___。
②若Y为淡黄色固体单质,写出Z→E的化学反应方程式___。
(2)盐酸、硫酸、硝酸是工业生产中常用的三种强酸。
①盐酸既有酸性,又能表现氧化性和还原性,其还原产物是___;若足量的MnO2与100mL12mol·L-1的浓盐酸反应,生成Cl2的物质的量___0.3mol(填:“大于”、“等于”、“小于”)。
②足量的锌与浓硫酸反应,反应开始时的化学方程式为___;反应快结束时的离子反应方程式为___。
③将6.4g铜与足量的浓硝酸反应,产生NO和NO2气体的体积为2.24L(STP),则参加反应的硝酸的物质的量为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】“环境就是民生,青山就是美丽,蓝天也是幸福。“拥有天蓝、地绿、水净的美好家园,是每个中国人的梦想。回答下列问题:
(1)排放到大气中的氮的氧化物,会造成___污染。
(2)化肥、炼油、稀土、钢铁等工业都会排放出高浓度的氨氮废水。氨氨废水是造成河流及湖泊富营养化的主要因素。
①某氮肥厂产生的氨氮废水中的氮元素多以NH4+和NH3·H2O形式存在,为达到变废为宝回收利用的目的。可采取的方法是___。
②某团队设计处理流程如下:
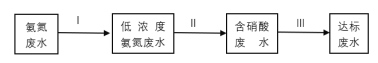
过程Ⅱ为硝化过程,在微生物的作用下实现NH4+→NO2-→NO3-的转化,在碱性条件下NH4+被氧气氧化成NO3-的总反应离子方程式为___。
过程Ⅲ为反硝化过程,向一定条件下的废水中加入甲醇(CH3OH)实现HNO3→NO2-→N2的转化,将lmol NO2-完全转化为N2,转移的电子数为___。
(3)磷酸生产及煤燃烧产生的废气SO2等会对大气造成污染。
①为防止工业煤燃烧产生SO2,常向燃煤中加入CaCO3浆状物进行脱硫,脱硫的产物用于制造石膏。脱硫反应的化学方程式为____。
②某兴趣小组对取得的酸雨样品进行pH测定,随着的简的推移,得到以下数据(pH越小,酸性越强)。
时间/h | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
雨水pH变化的主要原因是___(用化学方程式表示)。
③某硫酸化工厂,使用一种含杂质为25%的黄铁矿石(FeS2)为原料。若取2吨该矿石,可制得98%的浓硫酸___吨(假设生产过程中96%SO2转化为SO3)。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学上常用燃烧法确定有机物的组成。如图所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
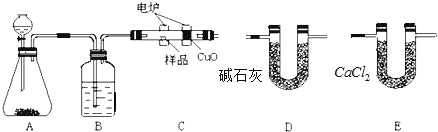
回答下列问题:
(1)若A中装有二氧化锰固体,发生反应的化学方程式为_____。
(2)B装置的作用是_____,燃烧管C中CuO的作用是_____。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E的连接顺序是:C→____→____。
(4)准确称取1.8g 烃的含氧衍生物X 的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,则该有机物的实验式(即最简式)是____,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为_____,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,X可能的结构简式为_____(任写一种合理结构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2是一种常用的化工原料,经常可以用来转化成高附加值的CO、CH4、CH3OH、CO(NH2)2等一碳(C1)产物。
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[
CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[![]() ],则y1__y2。
],则y1__y2。

Ⅱ.CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H=-49.01kJmol-1
CH3OH(g)+H2O(g) H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) H=-165.0kJmol-1
CH4(g)+2H2O(g) H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g) H=+41.17kJmol-1
CO(g)+H2O(g) H=+41.17kJmol-1
回答下列问题:(1)由CO、H2合成甲醇的热化学方程式为__。
(2)如图是某甲醇燃料电池工作的示意图。

质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2mol·L-1H2SO4溶液。电极a上发生的电极反应为___,当电池中有1mole发生转移时左右两侧溶液的质量之差为___g(假设反应物耗尽,忽略气体的溶解)。
(3)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按![]() =3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
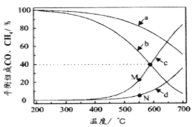
则表示1MPa时CH4和CO平衡组成随温度变化关系的曲线分别是___、___。M点所表示物质的平衡组成高于N点的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有短周期元素A、B、C、D。A元素M层上有2对成对电子,D与A在周期表中同一主族。由A、B与D组成的化合物的浓溶液是常见的干燥剂,常温下C单质为双原子分子,其氢化物水溶液呈碱性,是一种重要肥料。
(1)A的原子最外层共有___种不同运动状态的电子,该原子共有___种不同能量的电子,能量最高的电子占有___个轨道,其电子云形状为____。
(2)元素A、B与D组成的化合物的浓溶液是常见干燥剂,该化合物在实验室制备乙酸乙酯时所起的作用:_____。
(3)B与C元素形成带一个单位正电荷的离子,写出该微粒的电子式____。
(4)元素A与元素D相比,非金属性较强的是____(用元素符号表示),下列表述中能表明这一事实的是____。
①比较最高价氧化物对应水化物的酸性
②比较对应气态氢化物的稳定性
③一定条件下D能从A的氢化物水溶液中置换出A单质
④A单质的熔沸点明显高于D单质
从原子结构分析A和D非金属强弱的原因_____。
(5)C原子的原子结构示意图:_____,C的氢化物固态时属于____晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向FeCl3溶液中滴加KI溶液:2Fe3++2I-=2Fe2++I2
B.向氢氧化铜悬浊液中滴加稀硫酸:OH-+H+=H2O
C.过氧化氢使酸性高锰酸钾溶液褪色:H2O2+2MnO4-+6H+=4H2O+2Mn2++3O2↑
D.向NaHCO3溶液滴加少量澄清石灰水中:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
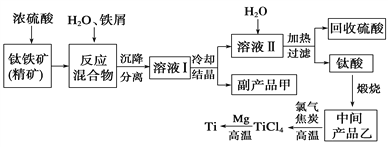
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.向某溶液中滴加少量AgNO3溶液,有白色沉淀产生,溶液中一定含有Cl-
B.向某溶液中加入一定量的稀硫酸,产生的气体使澄清石灰水变浑浊,溶液中一定含有SO32-或CO32-
C.将灼热的木炭与浓硝酸反应产生的气体缓缓通入澄清石灰水中,溶液没有沉淀产生
D.向某溶液中滴加少量浓NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明该溶液中一定不含NH4+
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
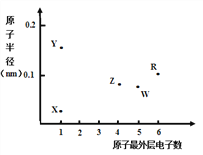
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中所含的原子总数为3NA
B.反应4FeS2+11O2![]() 2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
2Fe2O3+8SO2每生成2molFe2O3转移电子总数为44NA
C.22.4L的N2和O2所含的分子总数为NA,该混合气体所处的状况为标准状况
D.含1molFeCl3的饱和溶液滴加到沸水中,所得氢氧化铁胶体分散质的粒子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com