
科目: 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、、NH4+、Cl—、Mg2+、Ba2+、CO32—、SO42—,现取三份 100mL 溶液进行如下实验:(1)第一份加入 AgNO3 溶液有沉淀产生;(2)第二份加足量 NaOH 溶液加热后,收集到气体 0.04mol;(3)第三份加足量 BaCl2 溶液后,得干燥沉淀 6.27g,经足量盐酸洗涤、干燥后,沉淀质量为 2.33g。根据上述实验,以下推测正确的是( )
A.Cl—可能存在B.Ba2+一定不存在,Mg2+可能存在
C.c(K+)=0.1mol/LD.100mL 溶液中含有 0.01mol CO32—
查看答案和解析>>
科目: 来源: 题型:
【题目】胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法其中正确的是( )
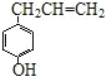
①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它存在能发生银镜反应的同分异构体;④1mol该化合物最多可与4mol H2发生加成反应
A.①③B.①②④C.②③D.②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S存在于多种燃气中,脱除燃气中H2S的方法很多。
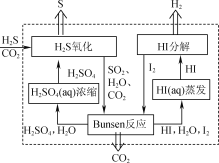
(1) 2019年3月《science direct》介绍的化学链技术脱除H2S的原理如图所示。
①“H2S氧化”反应中氧化剂与还原剂的物质的量之比为________。
②“HI分解”时,每1 mol HI分解生成碘蒸气和氢气时,吸收13 kJ的热量,写出该反应的热化学方程式:________。
③“Bunsen反应”的离子方程式为________。
(2) 电化学干法氧化法脱除H2S的原理如图所示。阳极发生的电极反应为________;阴极上COS发生的电极反应为________。
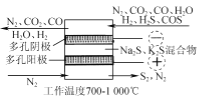
(3) 用Fe2(SO4)3吸收液脱除H2S法包含的反应如下:
(Ⅰ) H2S(g)![]() H2S(aq)
H2S(aq)
(Ⅱ) H2S(aq) ![]() H++HS-
H++HS-
(Ⅲ) HS-+2Fe3+=S↓+2Fe2++H+
一定条件下测得脱硫率与Fe3+浓度的关系如图所示。

①吸收液经过滤出S后,滤液需进行再生,较经济的再生方法是________。
②图中当Fe3+的浓度大于10 g·L-1时,浓度越大,脱硫率越低,这是由于________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,某化学小组探究硝酸银溶液的性质。
装置 | 实验序号 | 实验操作 | 实验现象 |
| 实验I | 向试管中滴加2%氨水并不断振荡 | 产生棕褐色沉淀,继续滴加沉淀消失 |
实验II | 1.向试管中加入0.1mol·L-lNaOH溶液1mL 2.继续滴加3%H2O2至过量 | 1.产生棕褐色沉淀 2.产生大量无色无味气体,有黑色沉淀生成 | |
实验III | 1.向试管中滴加1mL0.1molL-1KI溶液 2.取少量上层清液于试管甲中,加入淀粉溶液 | 1.产生黄色沉淀 2.溶液无明显变化 |
已知:AgOH是一种白色固体,常温下极不稳定,易分解为棕褐色难溶于水的氧化银固体
(1)常温下,0.1mo1L-1AgNO3溶液pH约为4,请用离子方程式解释原因___。
(2)实验I中,反应的化学方程式是___。
(3)实验II中,经检验,黑色沉淀的成分为Ag。有Ag产生的化学方程式是___。经测定,实验产生的气体体积远远大于该反应的理论值,可能的原因是___。
(4)实验中,产生黄色沉淀的离子方程式是___。有同学猜想,I-有还原性,Ag+有氧化性,AgNO3溶液与KI溶液应该可以发生氧化还原反应。他设计了如图原电池,做实验IV证明了猜想成立。其中,在A烧杯中,石墨电极表面变亮,经检测这种光亮的物质为银单质。乙溶液是___,检验B烧杯中产物的操作及现象是___,该氧化还原反应的离子方程式是__。

(5)对比实验III和实验IV,实验III无I2生成的可能原因是___(写出两条)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据 A-I 在周期表中的位置,用元素符号或化学式回答下列问题。
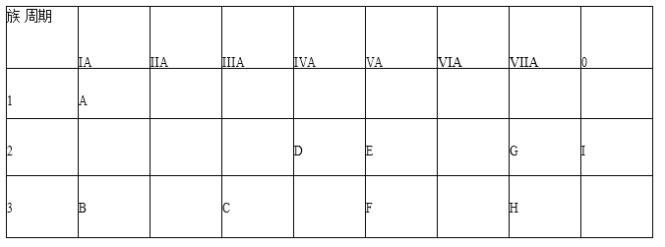
(1)表中元素,化学性质最不活泼的是_____,只有负价而无正价的是_____,氧化性最强的单质是____;
(2)最高价氧化物的水化物碱性最强的是_____,酸性最强的是_____,呈两性的是_____;
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的是_____;
(4)在 B、C、D、E、F、G、H 中,原子半径最大的是_____;
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外 M 电子层与 K 电子层上的电子数相等,甲、乙两元素相比较,金属性较强的是_______可以验证该结论的实验是_。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,可用于制备丙烯、氢气等。
(1)MTO法由甲醇制备丙烯时的反应原理是:甲醇先脱水生成二甲醚,然后二甲醚与甲醇的平衡混合物脱水转化为含丙烯较多的低聚烯烃。某温度下,在密闭容器中加入CH3OH气体,发生脱水反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
CH3OCH3(g)+H2O(g),一段时间后测得各组分的浓度如表所示。
物质 | CH3OH | CH3OCH3 | H2O |
5min浓度(mol·L-1) | 0.44 | 0.6 | 0.6 |
10min浓度mol·L-1) | 0.04 | 0.8 | 0.8 |
15min浓度(molL-1) | 0.04 | 0.8 | 0.8 |
该温度下,反应的平衡常数数值是___,CH3OH的平衡转化率是___。
(2)利用甲醇水蒸气重整制氢法是获得氢气的重要方法。反应原理如下:
反应i(主反应):CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)△H=+49kJmol-1
CO2(g)+3H2(g)△H=+49kJmol-1
反应ii(副反应):H2(g)+CO2(g)![]() CO(g)+H2O(g)△H=+41kJmol-1
CO(g)+H2O(g)△H=+41kJmol-1
①温度高于300℃则会同时发生CH3OH转化为CO和H2的副反应,该反应的热化学方程式是___。
②反应中,经常使用催化剂提高化学反应速率,但催化剂对反应具有选择性。一定条件下,测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

从图中可知,反应的适宜温度为___,随着温度的升高,催化剂对___(填“反应i”或“反应ii”)的选择性越低。
③TiO2纳米电极电化学还原法可将副产物CO2在酸性水溶液中电解生成甲醇,生成甲醇的电极反应式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用下图所示装置模拟石灰石燃煤烟气脱硫实验:

(1)实验中为提高石灰石浆液脱硫效率采取的措施是____,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式____。
(2)将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是____。
(3)研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是____,烟气通入石灰石浆液时的温度不宜过高,是因为____。

(4)石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3,实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,____。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温常压下,24mLH2S和O2的混合气体点燃后,生成6mLSO2,则原混合气体中H2S的体积可能为
A. 10mLB. 12mLC. 16mLD. 18mL
查看答案和解析>>
科目: 来源: 题型:
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如下:
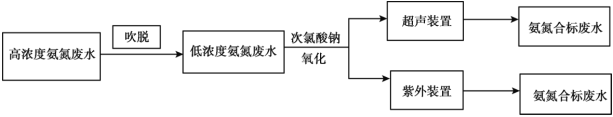
(1)吹脱法除氨氮:水中的氨氮大多数以![]() 和游离态的
和游离态的![]() 保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中
保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移,从而达到脱除氨的目的。氨氮废水中![]() 和
和![]() 平衡态的平衡关系有________。
平衡态的平衡关系有________。
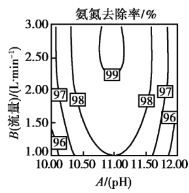
(2)温度、![]() 值、空气流量对脱除氨有很大的影响。
值、空气流量对脱除氨有很大的影响。![]() 值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,
值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,![]() 时,吹脱率随着
时,吹脱率随着![]() 增加而增加,请用化学平衡移动原理解释原因________。
增加而增加,请用化学平衡移动原理解释原因________。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是________。
II.对于含有![]() 的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生
的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生![]() ,在通入
,在通入![]() 的情况,又产生
的情况,又产生![]() ,以氧化水中的
,以氧化水中的![]() ,同时
,同时![]() 还可以通过生成
还可以通过生成![]() 沉淀而持续被除去。
沉淀而持续被除去。
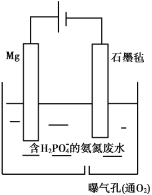
(1)阳极的电极反应式是________。
(2)废水中的![]() 转化为
转化为![]() 的离子方程式是________。
的离子方程式是________。
(3)![]() 大于
大于![]() 不利于
不利于![]() 的生成,原因是________。
的生成,原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com