
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
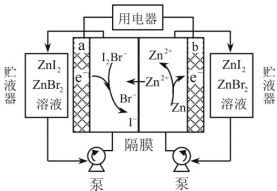
下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A.0.01mol·L-1B.0.017mol·L-1
C.0.05mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )
A.由反应:M(s)+N(g) ![]() R(g) △H1 ,M(g)+N(g)
R(g) △H1 ,M(g)+N(g) ![]() R(g) △H2,得出△H 2>△H 1
R(g) △H2,得出△H 2>△H 1
B.已知:2SO2(g)+O2(g) ![]() 2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
2SO3(g);△H=-98.3kJ/mol。将1molSO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量
C.电解精炼铜时,电源负极与纯铜相连,且电解质溶液浓度始终保持不变
D.用惰性电极电解 Na2SO4溶液,当阴极产生1mol气体时,可加18 g 水使溶液恢复
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是电解饱和 NaCl 溶液的实验装置,x、y 都是惰性电极,a 是饱和 NaCl 溶液,同时在两边各滴入几滴酚酞试液,下列有关该实验正确的说法是

A.x 电极为阳极,y 电极为阴极
B.x 电极附近溶液变红色,且有刺激性气味气体产生
C.若将两电极产生的气体收集起来,X电极得到的气体与Y电极得到的气体之比之比略大于 1:1
D.电解后,将溶液混匀,电解前后溶液的 pH 未发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是反应CO(g) +2H2(g) ![]() CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
CH3OH (g)过程中的能量变化如下图所示,曲线a和b分别表示不使用催化剂和使用催化剂的两种情况。下列相关说法正确的是( )
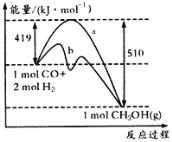
A.加入催化剂,该反应的△H变小
B.如果该反应生成液态CH3OH,则△H变大
C.该反应的△H=+91 kJ/moL
D.反应物的总能量大于生成物的总能量
查看答案和解析>>
科目: 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
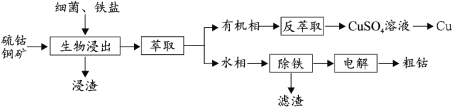
回答下列问题:
(1)Cu2+的生物浸出原理如下:
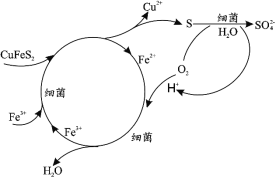
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目: 来源: 题型:
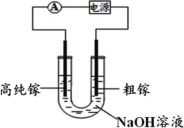
【题目】镓(31Ga)、锗(32Ge)都是重要的稀有金属,在化学催化剂、半导体材料、新能源等领域应用广泛,可从锗煤燃烧后的粉煤灰(含 Ga2O3、GeO2、SiO2、Al2O3)中提取, 部分流程如下:

已知:
物质 | GaCl3 | GeCl4 | AlCl3 |
沸点/℃ | 201 | 84 | 183(升华) |
(1)滤渣的主要成分为_____。
(2)①中发生的反应有 Al2O3+6H+=2Al3++3H2O、Ga2O3+6H+=2Ga3++3H2O 和_____。
(3)操作 a 的名称是_____,②中控制温度的范围是_____(填字母序号)。
a.20~84℃ b.84~183℃ c.84~201℃
(4)④中发生反应的化学方程式是__________________________________________。
(5)镓能与沸水剧烈反应生成氢气,锗在加热条件下与盐酸或稀硫酸不反应。从原子结构角度解释其原因:______________________
(6)用浓盐酸酸化的磷酸三丁酯(TBP)可以从残液中萃取 Ga3+,相关反应为:TBP+GaCl3+HCl![]() TBPH+·GaCl
TBPH+·GaCl![]() 。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
。用稀 NaOH 溶液对有机相进行反萃取,用盐酸调节反萃取液 pH 至 5~6,然后升温至 85~95℃水解得到 Ga(OH)3,经后续处理得到粗镓。结合化学用语解释用稀 NaOH 溶液对有机相进行反萃取的原因:_________________。
(7)电解法可以提纯粗镓,具体原理如图所示。镓在阳极溶解生成的 Ga3+与 NaOH 溶液反应生成 GaO![]() ,GaO
,GaO![]() 在阴极放电的电极反应式是_____________________。
在阴极放电的电极反应式是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:

回答下列问题:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________。
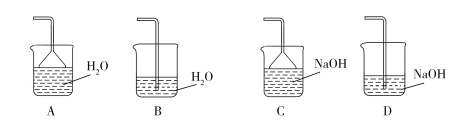
(2)步骤②需要加热的目的是_________________,温度保持80~95 ℃,采用的合适加热方式是_________________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________(填标号)。
(3)步骤③中选用足量的H2O2,理由是_________________。分批加入H2O2,同时为了_________________,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com