
科目: 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在100℃时,将0.100mol的N2O4气体充入1L抽空密闭容器中,发生反应:N2O4(g)2NO2.现在隔一定时间对该容器内的物质进行分析,得到如下表格:
t/s c/(molL﹣1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(molL﹣1) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2)/(molL﹣1) | 0 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试回答下列问题:
(1)达到平衡时N2O4的转化率为_____%,表中c2_____c3,a_____b(后两空选填>、<、=)
(2)20 s的N2O4的浓度c1=_____mol/L在0~20s内N2O4的平均反应速率为_____mol/(Ls);
(3)若其他反应条件以及初始物质物质的量不变,将反应的温度降低到80℃时,达到平衡时NO2的物质的量为0.100 mol,那么正反应是_____反应(选填吸热或放热)
(4)若在相同初始情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度为_____mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中两溶液间的反应,不能用同一离子方程式来表示的是( )
A.Na2CO3+HCl;K2CO3+HNO3
B.Fe+HCl;Fe+H2SO4
C.BaCl2+Na2SO4;Ba(OH)2+H2SO4
D.NaOH+H2SO4;Ba(OH)2+HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】当反应L(s)+aG(g) ![]() bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g)达到平衡后,温度和压强对该反应的影响如图所示,图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
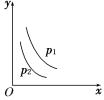
A. 上述反应是放热反应 B. 上述反应是吸热反应
C. a>b D. a<b
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A. H2SO4溶液与Ba(OH)2溶液反应:Ba2++OH﹣+H++![]() →BaSO4↓+H2O
→BaSO4↓+H2O
B. 将Na投入到CuSO4溶液中:2Na+Cu2+===2Na++Cu↓
C. 大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO﹣+CO2↑+H2O
D. 将Cl2通入水中:Cl2+H2O===2H++Cl﹣+ClO﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】为了更好地表示溶液的酸碱度,科学家提出了酸度(AG)的概念.定义:AG=lgc(H+)/c(OH-),则下列叙述中正确的是( )
A.中性溶液AG=0
B.酸性溶液AG>0
C.常温下0.1mol/L的氢氧化钠溶液的AG=12
D.常温下0.1mol/L的醋酸溶液的AG=12
查看答案和解析>>
科目: 来源: 题型:
【题目】今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
查看答案和解析>>
科目: 来源: 题型:
【题目】向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之间 D. 大于0.45 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】卤族元素及其化合物的用途非常广泛。回答下列问题:
(1)基态氯原子价电子轨道表示式(电子排布图)为___;处于最高能级电子云轮廓图形状为____。
(2)![]() 和
和![]() 的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
的中心原子相同且杂化方式也相同,它们的键长和键角如下图所示:
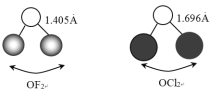
①O-F键的键长比O-Cl键的小,其原因是______。
②键角:∠FOF_____(填“>”、“<”或“=”)∠ClOCl。
(3)①试解释酸性HBrO4>HBrO3的原因_________。
②试解释酸性HClO3>HBrO3>HIO3的原因_________。
(4)![]() 的熔点为1040℃;
的熔点为1040℃;![]() 的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
的熔点为194℃,沸点为181℃,前者的熔点比后者高得多,其原因是______。
(5)氯化亚铜晶胞结构如图所示,晶胞参数a=0.542nm。
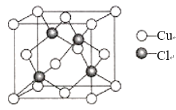
①Cu+的配位数为_____。
②氯化亚铜的密度为____![]() (用含NA的计算式表示)。
(用含NA的计算式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com