
科目: 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温,下列各组离子一定能在指定溶液中大量共存的是( )
A.![]() =10-12的溶液中:
=10-12的溶液中:![]() 、Cu2+、
、Cu2+、![]() 、
、![]()
B.滴加KSCN溶液显红色的溶液中:![]() 、K+、Cl-、I-
、K+、Cl-、I-
C.0.1mol·L-1的NaHCO3溶液中:Fe3+、K+、Cl-、![]()
D.水电离产生的c(OH-)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124gP4中所含P—P键数目为4NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
C.17g甲基(—14CH3)所含的电子数目为10NA
D.1.5molFeI2与22.4LCl2完全反应时转移的电子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】水合肼(N2H4·H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,其制备的反应原理为NaClO+2NH3===N2H4·H2O+NaCl。下列关于实验室制备水合肼的操作不正确的是( )
甲 乙
乙 丙
丙 丁
丁
A. 装置甲中试剂X可以选择生石灰 B. 装置乙作为反应过程的安全瓶
C. 装置丙制备水合肼时氨气从b口进入 D. 装置丁可用于吸收多余的尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
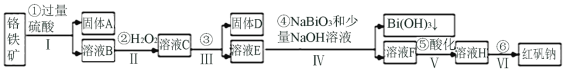
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为![]() 。
。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)Fe在元素周期表中的位置______________________________,反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的______________。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使![]() 转化为
转化为![]() ,写出该反应的离子方程式_________________。
,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气是重要的化工原料,可以用来制备硝酸以及各种化肥产品.
(1)氨分子的电子式为_____.
(2)写出一水合氨的电离方程式_____;现在在10 mL 0.1 mol/L的一水合氨溶液中滴加0.1mol/L的盐酸,若要使在常温下混合溶液的pH=7,那么需要滴加盐酸溶液的体积_____10ml(选填大于、等于、小于)
(3)用两根玻璃棒,一根蘸取浓氨水,一根蘸取浓硫酸,当两根玻璃棒靠近时,出现的现象是_____;该反应的化学方程式为_____.
查看答案和解析>>
科目: 来源: 题型:
【题目】课外活动时间玛丽同学制备Fe(OH)3胶体,具体操作如下:首先在烧杯中加入25mL蒸馏水,用酒精灯加热至沸腾,然后向烧杯中逐滴滴加6滴FeCl3饱和溶液,并继续煮沸至液体呈透明的红褐色,即得Fe(OH)3胶体。试回答下列问题:
(1)写出该反应的化学方程式:___。
(2)如何证明玛丽同学是否成功制得胶体_____?
(3)若玛丽同学在滴加FeCl3饱和溶液的同时用玻璃棒不断搅拌,结果没有得到胶体,为什么呢_____?
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4-2H2O,M=180g.mol-1)为淡黄色固体,难溶于水,可用作电池正极材料磷酸铁锂的原料。回答下列问题:
实验1探究纯草酸亚铁晶体热分解产物
(1)气体产物成分的探究,设计如下装置(可重复选用)进行实验:
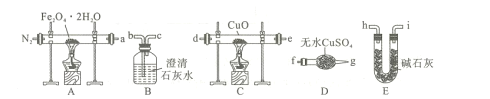
①装置B的名称为 ____。
②按照气流从左到右的方向,上述装置的连接顺序为a→___ →点燃(填仪器接口的字母编号)。
③为了排尽装置中的空气,防止加热时发生爆炸,实验前应进行的操作是____。
④C处固体由黑变红,其后的澄清石灰水变浑浊,则证明气体产物中含有____。
(2)固体产物成分的探究,待固体热分解充分后,A处残留黑色固体。黑色固体可能是Fe或FeO,设计实验证明其成分为FeO的操作及现象为____。
(3)依据(1)和(2)结论,A处发生反应的化学方程式为____。
实验2草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的流程如下图:

(4)草酸亚铁晶体溶解酸化用KMnO4溶液滴定至终点的离子方程式为____。
(5)草酸亚铁晶体样品的纯度为 ____(用代数式表示),若配制溶液时Fe2+被氧化,则测定结果将____(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯可作化工原料和清洁能源,研究其制备和综合利用具有重要意义,请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) ΔH制备乙烯。
C2H4(g)+H2(g) ΔH制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
O2(g)=H2O(l) ΔH2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) ΔH3=-1559.9kJ·mol-1。
则ΔH=______kJ·mol-1。
(2)乙烯可制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
C2H5OH(g)。向2L某恒容密闭容器中充入a mol C2H4(g)和a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如下图所示:
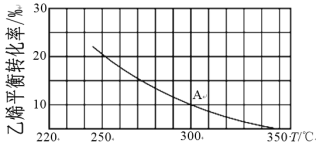
①该反应为______热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____mol,计算A点对应温度下的平衡常数K=_____(用含a的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是____(填选项字母)。
a.k正增大,k逆减小 b.k正减小,k逆增大c.k正增大的倍数大于k逆 d.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率_____10%(填“>”、“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是某种低毒利尿药的主要成分。其合成路线如下(部分条件已略):
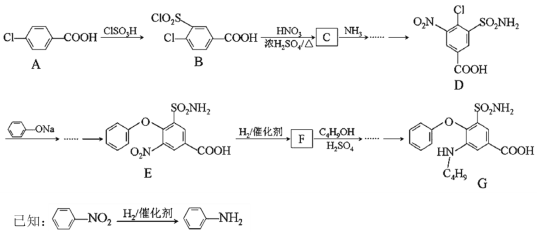
回答下列问题:
(1)A的化学名称______,A中的官能团_______。
(2)A→B的反应类型______,E→F的反应类型_______。
(3)D的分子式_____,F的结构简式_______。
(4)B→C的化学反应方程式________。
(5)若G发生自身缩聚反应,其缩聚产物的链节结构为________(写一种)。
(6)C4H9OH的同分异构体中属于醇的有___种,其中核磁共振氢谱图中有四组峰的同分异构体的结构简式为___。
(7)以甲苯(其他无机试剂任选)为原料合成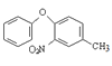 的合成路线为_______。
的合成路线为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com