
科目: 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
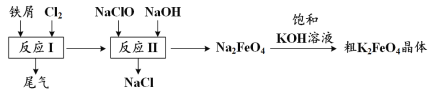
下列叙述不正确的是
A.用K2FeO4对饮用水杀菌消毒的同时,还产生Fe(OH)3胶体吸附杂质净化水
B.用FeCl2溶液吸收反应I中尾气后可再利用
C.反应II中氧化剂与还原剂的物质的量之比为3∶2
D.该生产条件下,物质的溶解性:Na2FeO4< K2FeO4
查看答案和解析>>
科目: 来源: 题型:
【题目】煤、石油、淀粉都是基础的化工原料,它们之间存在如下关系(部分产物和反应条件未标出)。B为相对分子质量为28的烃;E为淀粉水解的最终产物;F分子中含有一个甲基和一个羧基,lmolF与足量的钠反应能生成标况下22.4LH2;D物质中也含有羧基。
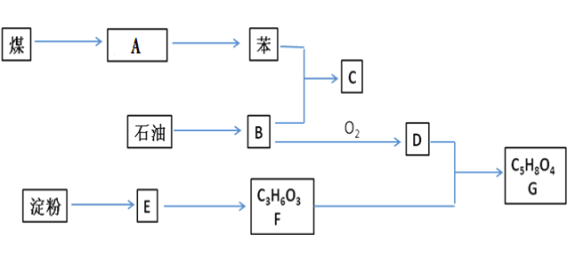
回答下列各题:
(1)若A为煤焦油,则从A中分离出苯的方法是__________,工业上通过石油的________制B物质.
(2)C为乙苯,则苯和B生成C的反应类型是____________, C的结构简式是____________.
(3)写出B制备聚乙烯的反应方程式_____________________________________________.
(4)写出D与F转化为G的反应方程式________________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化氢直接氧化法制氯气的反应是4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
2Cl2(g)+2H2O(g)。刚性容器中,进料浓度比c(HCl):c(O2)分别等于1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如图所示。下列说法不正确的是( )
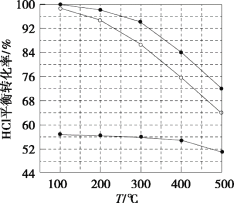
A.K(300℃)>K(400℃)
B.增加反应的压强和及时分离出氯气都可以提高氯化氢的转化率
C.当c(HCl):c(O2)进料比过低时,HCl的转化率较低,且不利于分离O2和Cl2
D.若HCl的初始浓度为c,进料比为1:1时,K(500℃)=![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是

A. X是硫元素
B. Y的最高价氧化物的电子式为 ![]()
C. W的最高价氧化物对应的水化物中仅含离子键
D. Z的最高价氧化物对应水化物的化学式为HClO4
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述不正确的是
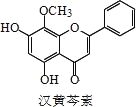
A.汉黄芩素的分子式为 C16H12O5
B.该物质遇 FeCl3 溶液显色
C.1 mol 该物质与溴水反应,最多消耗 2mol Br2
D.与足量 H2 发生加成反应后,该分子中官能团的种类减少 3 种
查看答案和解析>>
科目: 来源: 题型:
【题目】全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有![]() 和N5-两种离子)的重要中间体。下列说法中不正确的是( )
和N5-两种离子)的重要中间体。下列说法中不正确的是( )
A.全氮类物质属于绿色能源B.每个N5+中含有5个原子核
C.每N5-中含有36个质子D.N10结构中含非极性共价键和离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3 是合成其他含钴配合物的重要原料。在活性炭的催化作用下,通过氧化二氯化六氨合钴(II)得到三氯化六氨合钴(III)制备流程如下:
![]()
资料:
①钴离子常见价态有+2(II)价,+3(III)价,Co(II)离子能在水溶液中稳定存在,但 Co(III)离子不能稳定存在,只能以固态或络合物形式(如[Co(NH3)6]3+)稳定存在溶液中。
② Co2+在 pH=9.4 时完全沉淀为 Co(OH)2
(1) 实验中需要将 CoCl2·6H2O 晶体研细,其目的是:__________________。
(2)在加入浓氨水前先加入大量 NH4Cl溶液,请结合平衡原理解释原因______________________。
(3)在“氧化”过程中需水浴控温在 50~60℃,温度不能过高,原因是______________________。
(4)写出“氧化”过程中反应的离子方程式_______________。
(5)为测定产品中钴的含量,进行下列实验:
①称取样品 4.000 g 于烧瓶中,加水溶解,加入足量的 NaOH 溶液,加热至沸 15~20 min,将 [Co(NH3)6]Cl3 完全转化为 Co(OH)3,冷却后加入足量 KI 固体和 HCl 溶液,充分反应一段时间后,将烧瓶中的溶液全部转移至 250.00 mL 容量瓶中,加水定容,取其中 25.00 mL 试样加入到锥形瓶中;
②用 0.100 0 mol·L -1 Na2S2O3 标准溶液滴定,溶液变为浅黄色后,加入淀粉溶液作指示剂继续滴定至终点,重复 2 次实验,测得消耗 Na2S2O3 溶液的平均体积为 15.00 mL。(已知:2Co3++2I-=2Co2++I2 ,I2 +2S2O32-=2I-+S4O62-).通过计算确定该产品中钴的含量___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】.实验室要配制240mL 0.2mol·L-1的Na2CO3溶液,试回答下列各题:
(1)若用Na2CO3固体配制溶液,下列仪器中,不需要用到的是______________。
A.锥形瓶 B.200mL容量瓶 C.烧杯 D.胶头滴管
E.药匙 F.托盘天平 G.洗瓶 H.试剂瓶
(2)若要实施配制,除上述仪器外,尚缺的必须的仪器是________________________。
(3)需要称量Na2CO3固体的质量是____________________________ 。
(4)下列四项操作会导致所得溶液浓度偏高的是__________。
a.容量瓶不干燥
b.定容时俯视容量瓶刻度线
c.称量Na2CO3固体时物体和砝码放反了(1克以下用游码)
d.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
查看答案和解析>>
科目: 来源: 题型:
【题目】药物利伐沙班临床主要用于预防髋或膝关节置换术患者静脉血栓栓塞。药物利伐沙班的合成路线如下:
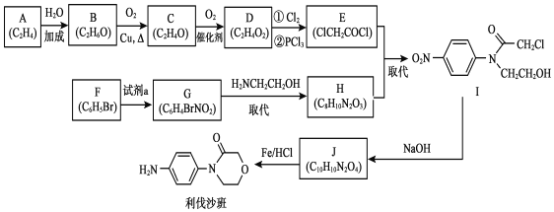
已知:R—X+![]()
![]()
![]() +HX (R代表烃基)
+HX (R代表烃基)
(1)B→C 的化学方程式是___________。
(2)C→D 的反应类型是________。
(3)F 的结构简式是_________。
(4)F→G 所需的试剂a 是____________。
(5)G→H 的化学方程式是____________。
(6)以![]() 为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。
为原料,加入 ClCH2CH2OCH2COCl,也可得到 J,将下列流程图补充完整:____、____。

(7)J制备利伐沙班时,J发生了还原反应,同时生成了水,则J与HCl物质的量之比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com