
科目: 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
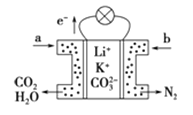
A.a为![]() ,b为
,b为![]()
B.在熔融电解质中,![]() 向正极移动
向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是一种非天然氨基酸,其合成路线如下:
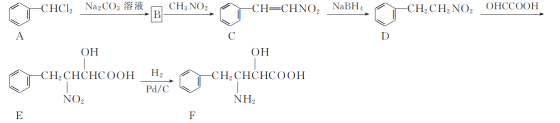
(1) C中官能团的名称为________。
(2) D→E的反应类型为________。
(3) B的分子式为C7H6O,写出B的结构简式:________。
(4) D的一种同分异构体X同时满足下列条件,写出X的结构简式: ________。
①六元环状脂肪族化合物;
②能发生银镜反应,1 mol X反应能生成4 mol Ag;
③分子中只有4种不同化学环境的氢。
(5) 写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】足量铜与一定量浓硝酸反应,得到硝酸铜溶液和![]() 、
、![]() 的混合气体,这些气体与
的混合气体,这些气体与![]() (标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入
(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入![]() 溶液至
溶液至![]() 恰好完全沉淀,则消耗
恰好完全沉淀,则消耗![]() 溶液的体积是( )
溶液的体积是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】为达到下列实验目的,对应的实验方法以及相关解释均正确的是
选项 | 实验目的 | 实验方法 | 相关解释 |
A | 测量氯水的pH |
| pH试纸遇酸变红 |
B | 探究正戊烷C5H12催化裂解 |
| C5H12裂解为分子较小的烷烃和烯烃 |
C | 实验温度对平衡移动的影响 |
| 2NO2 |
D | 用AlCl3溶液制备AlCl3晶体 |
| AlCl3沸点高于溶剂水 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下,下列有关说法正确的是( )
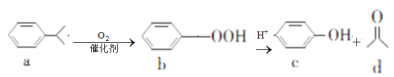
A.a、b、c均属于芳香烃B.a、d中所有碳原子均处于同一平面上
C.a有9种属于芳香族的同分异构体D.c、d均能发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,1mol -OH中含有9NA个电子
B.在精炼铜的过程中,当阳极有32g铜参加反应时转移电子数为NA
C.常温下,0.1mol环氧乙烷(![]() )中含有的共价键数目为0.3NA
)中含有的共价键数目为0.3NA
D.1L0.5mol/LpH=7的CH3COONH4溶液中![]() 数目为0.5NA
数目为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
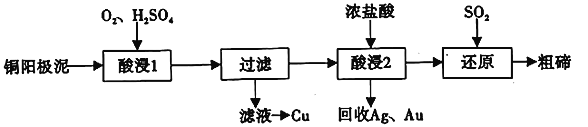
已知:TeO2微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为VIA族元素,TeO2被浓NaOH溶液溶解,所生成盐的化学式为____________。
(2)“酸浸2”时温度过高会使Te的浸出率降低,原因是________________________。
(3)“酸浸1”过程中,控制溶液的酸度使Cu2Te转化为TeO2,反应的化学方程式为____________;
“还原”过程中,发生反应的离子方程式为_____________________________。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为TeO2,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为____________________。在阳极区溶液中检验出有TeO42-存在,生成TeO42-的原因是_____________________。
(5)常温下,向l mol·L-1 Na2TeO3溶液中滴加盐酸,当溶液pH=5时,c(TeO32-):c(H2TeO3)=__________。(已知:H2TeO3的Ka1=1.0×10-3 Ka2=2.0×10-8)
查看答案和解析>>
科目: 来源: 题型:
【题目】莽草酸(E)主要作为抗病毒和抗癌药物中间体, 作为合成治疗禽流感药物达菲(Tamiflu)的主要原料之一。其合成路线如下:

回答下列问题:
(1)A的化学名称是_____。D的分子式为_____。莽草酸(E)中含氧官能团的名称是_____。
(2)①的化学反应类型为_____。
(3)C与足量NaOH稀溶液反应的化学方程式为______。
(4)设计步骤②、③的目的是________。
(5) F是B的一种同分异构体,能与FeCl3溶液发生显色反应且核磁共振氢谱只有两组峰,则F的结构简式为____。
(6)有机材料G(属降冰片烯酸类,结构简式:![]() )用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和
)用作医药中间体,依据题中合成路线设计以A(CH2=CH—COOH)和![]() 为起始原料制备G的合成路线(无机试剂任选)______。
为起始原料制备G的合成路线(无机试剂任选)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸可用作食品的防腐剂,实验室用苯乙酮间接电氧化法合成苯甲酸,原理如图所示:
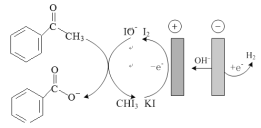
实验步骤如下:
步骤I:电氧化合成
在电解池中加入适量 KI、20mL蒸馏水和20 mL的1,4-二氧六环,搅拌至完全溶解,再加入23.30 mL苯乙酮,连接电化学装置,恒定电流电解3h;
步骤II:清洗分离
反应停止后,将反应液转移至烧瓶,蒸馏除去反应溶剂;用蒸馏水和二氯甲烷洗涤烧瓶,将洗涤液转移至分液漏斗;用二氯甲烷萃取除去亲油性杂质,分离出水相和有机相;
步骤III:制得产品
用浓盐酸酸化水相至pH为1~2,接着加入饱和KHSO3溶液,振荡、抽滤、洗涤、干燥,称量得到产品12.2 g;
有关物质的数据如下表所示:
物质 | 分子式 | 溶解性 | 沸点(℃) | 密度(g/cm3) | 相对分子质量 |
苯乙酮 | C8H8O | 难溶于水 | 202.3 | 1.03 | 120 |
苯甲酸 | C7H6O2 | 微溶于水 | 249 | 1.27 | 122 |
二氯甲烷 | CH2Cl2 | 不溶于水 | 40 | 1.33 | 85 |
回答下列问题:
(1)步骤I中,阴极的电极反应式为___,阳极I-失去电子后的产物与OH-反应的离子方程式为_。
(2)步骤II蒸馏过程中,需要使用到的下图玻璃仪器有_______(填字母),除下图外完成蒸馏操作还需的玻璃仪器______(填仪器名称)。
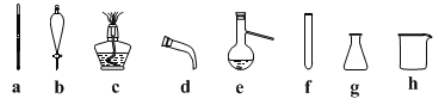
(3)步骤II分液过程中,应充分振荡,静置分层后________(填字母)。
A.依次将有机相、水相从分液漏斗的上口倒出
B.依次将有机相、水相从分液漏斗的下口放出
C.先将有机相从分液漏斗的下口放出,再将水相从下口放出
D.先将有机相从分液漏斗的下口放出,再将水相从上口倒出
(4)步骤III中,加入浓盐酸的目的是_________。
(5)步骤III中,加入饱和NaHSO3溶液,水相中的颜色明显变浅,说明过量的I2被还原为I-,其离子方程式为___________。
(6)本实验的产率是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硫氰[(SCN)2]为拟卤素,其分子及阴离子的性质与卤素性质相似。将硫氰化钾溶液与氯化铁溶液混合,溶液变为红色。完成下列填空:
(1)写出该反应的化学方程式:__。
(2)将生成的红色溶液分为三等份,进行如下实验(第三份是对照):
①第一份中加入碘化钾溶液至过量,再加入四氯化碳,充分振荡,最终水层接近无色,四氯化碳层呈___色,写出该过程的离子方程式:__。向该溶液中滴加少量溴水,水溶液又变为红色,则氧化性Br2___(SCN)2(填“大于”、“小于”或“无法确定”)。
②第二份中加入少量酸性高锰酸钾溶液,红色褪去。完成并配平该反应的离子方程式。若含___mol高锰酸钾的溶液完全反应,转移电子2mol。
__+_+__→__+__(SCN)2+__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com