
科目: 来源: 题型:
【题目】钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。
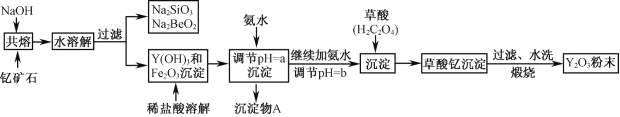
已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 2.1 | 3.1 |
Y3+ | 6.0 | 8.2 |
②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)写出Na2SiO3的一种用途________________________。
(2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。
① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。
A.NaOH溶液 B.氨水 C.CO2 D.HNO3
② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。
(3)常温下,反应Fe3++3H2O(g) ![]() Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。
(4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】写出下列物质的电子式:
(1)Cl2____________ (2)N2___________ (3)H2O___________
(4)NaOH __________(5)CH4___________ (6)CO2__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2)制取MnSO4·H2O并回收单质硫的工艺流程如下:
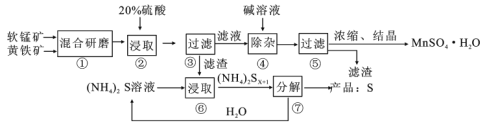
(1)步骤①混合研磨成细粉的主要目的是__________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3,则反应的离子方程式为___________。
(2)步骤③所得酸性滤液可能含有Fe2+,检验Fe2+的方法是________;除去Fe2+的方法是__________。步骤④是破坏Fe(OH)3胶体并使沉淀颗粒长大,便于过滤分离。步骤⑤所得滤渣为___________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为___________。
(4)硫化铵水解的离子方程式为:S2-+![]() +H2O
+H2O![]() HS-+NH3·H2O,如何判断溶液的酸碱性______。
HS-+NH3·H2O,如何判断溶液的酸碱性______。
(5)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1 KMnO4标准溶液滴定至浅红色且半分钟不褪,消耗标准溶液V mL,滴定反应的离子方程式为2![]() +3Mn2++2H2O=5MnO2↓+4H+,产品中Mn2+的质量分数为ω(Mn2+)=___________。
+3Mn2++2H2O=5MnO2↓+4H+,产品中Mn2+的质量分数为ω(Mn2+)=___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸氯喹(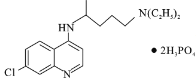 )是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹(
)是抑制新型冠状病毒的“有效药物”。磷酸氯喹可由氯喹( )和磷酸在一定条件下制得。氯喹的合成路线如下:
)和磷酸在一定条件下制得。氯喹的合成路线如下:

(1)有机物A的名称是___________,E中含氧官能团的名称是___________。
(2)反应①、②的反应类型分别是___________、___________。
(3)写出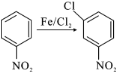 的方程式_______________。
的方程式_______________。
(4)F的结构简式是___________。
(5)反应③的另一种产物为___________。
(6)M是H的一种同分异构体,写出满足下列条件的M的结构简式(不考虑立体异构,只需写出2种)____________________。
①分子结构中含有苯环(无其他环),且苯环上有三个取代基;
②能使溴水褪色;
③核磁共振氢谱有4组峰,峰面积之比为2:1:1:1。
(7)设计由甲苯为起始原料制备 的合成路线(无机试剂任选)___________。
的合成路线(无机试剂任选)___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。已知Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
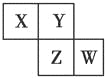
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. 氢化物的稳定性:X>Y>Z
D. 四种元素的单质中,Z单质的熔、沸点最高
查看答案和解析>>
科目: 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是国际上公认安全、无毒的绿色消毒剂,在常温下是一种黄绿色有刺激性气味的气体熔点为-59℃,沸点为11.0℃,易溶于水。ClO2有多种制备方法。
I.某实验小组拟用图示装置模拟工业制取并收集ClO2。
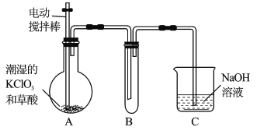
(1)A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、_________。
(2)B装置必须放在冰水浴中,其原因是___________。
II.我国的科学家经过科学探索,发现一种ClO2的制备方法,该方法安全性好,没有产生毒副产品。将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内,即生成ClO2。
(3)化学反应方程式为:___________。
III.以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。实验室模拟该过程的实验装置(夹持装置略)如图所示。
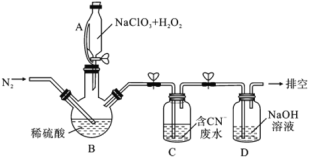
(4)反应容器B应置于30℃左右的水浴中,目的是_________。
(5)通入氮气的目的除了有利于将ClO2排出,还有____________。
(6)ClO2处理含CN-废水的离子方程式为______。装置D的作用是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com