
科目: 来源: 题型:
【题目】现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:
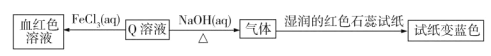
下列说法错误的是
A.原子半径:Y>Z>XB.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态D.Y3Z4是共价化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g) △H上述反应分两步完成,如图1所示。
2NO2(g) △H上述反应分两步完成,如图1所示。
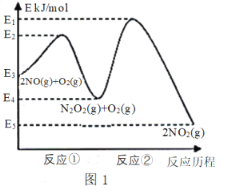
回答下列问题:
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):___________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
2NO2(g)反应速率的是_______(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是_________(反应未使用催化剂)。
(3)T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
2NO2(g)。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
①从0~2s该反应的平均速率v(NO2)=___________mol/(L·s)。
②T1温度时化学平衡常数K=___________mol-1·L。
③化学平衡常数K与速率常数k正、k逆的数学关系是K=___________。若将容器的温度改变为T2时其k正=k逆,则T1__________T2 (填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为_________________________。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图:
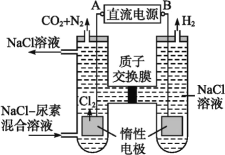
①电源的负极为________(填“A”或“B”)。
②阳极室中发生的反应依次为__________________________、____________________________。
③电解结束后,阴极室溶液的pH与电解前相比将________;若两极共收集到气体13.44 L(标准状况),则除去的尿素为________g(忽略气体的溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
回答下列问题:
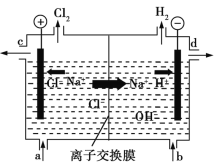
(1)写出电解饱和食盐水的离子方程式:_______________________________。
(2)离子交换膜的作用为_________________。
(3)精制饱和食盐水从图中____(填“a”、“b”、“c”或“d”,下同)位置补充,氢氧化钠溶液从图中____位置流出。
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】通常监测SO2含量是否达到排放标准的反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl。NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1 molBaCl2晶体中所含离子总数为0.1NA
B.25℃时,pH=1的HCl溶液中含有H+ 的数目为0.1NA
C.l7g H2O2中含有非极性键数目为0.5NA
D.生成2.33gBaSO4沉淀时,转移电子数目为0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铬铁矿的成分主要为 FeCr2O4 ,另含有少量 Al2O3 和 SiO2 。从铬铁矿中提取铁、铬的化合物,并获得副产物的工艺流程如下:
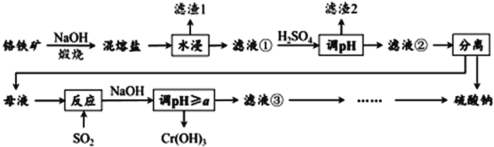
已知:铬铁矿FeCr2O4 中Cr元素在化合价为+3,“ 混熔盐 ” 中含有 Na2CrO4 和 NaFeO2 等成分,其中 NaFeO2 极易水解。试回答下列问题:
(1) “滤渣 1 ”为红褐色沉淀,其化学式为 _________________ ;
(2) 向滤液①中加 H2SO4 “调“ pH ”的目的:一是使 CrO![]() 转化为 Cr2O
转化为 Cr2O![]() ,离子方程式为 __________________ ;二是______________ 。
,离子方程式为 __________________ ;二是______________ 。
(3) “煅烧”铬铁矿时,主要成分反应的化学方程式为 _____________________ 。
(4) 根据下图溶解度(S)~温度(T) 曲线判断,

对滤液②进行的最佳“分离”方法为 ________( 填序号 ) 。
A. 蒸发结晶 B. 蒸发浓缩,趁热过滤 C. 蒸发浓缩,冷却结晶,过滤
(5) “反应”的离子方程式为 ____________________________ 。
(6) 已知 25 ℃时,Cr(OH) 3 的溶度积常数 Ksp [Cr(OH) 3 ]= 1.0 × 10 -32 。则使 Cr 3+恰好完全沉淀,即溶液中c(Cr 3+ )=1.0 × 10 -5 mol/L 时,应调节pH 的最小值a为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在T℃时,向1 L固定体积的密闭容器M中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g) ![]() aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
aZ(g)+W(g) ΔH=-Q kJ/mol(Q>0);该反应达到平衡后,放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小。请回答下列问题:
(1)化学计量数a的值为________。
(2)下列能说明该反应达到了化学平衡状态的是________(填序号)。
a.容器内压强一定 b.容器内气体的密度一定
c.容器内Z的分子数一定 d.容器内气体的质量一定
(3)维持T℃温度不变,若起始时向容器M中加入2 mol X、1 mol Y和1 mol Ar(稀有气体不参与反应),则反应达到平衡后放出的热量是________kJ。
(4)维持T℃温度不变,若在一个和原容器体积相等的恒压容器N中加入2 mol X和1 mol Y,发生题给反应并达到平衡,则________(填“M”或“N”)容器中的反应先达到平衡状态,容器中X的质量分数M________N(填“>”、“<”或“=”)。
(5)已知:该反应的平衡常数随温度的变化情况如表所示:
温度/℃ | 200 | 250 | 300 | 350 |
平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
若在某温度下,2 mol X和1 mol Y在容器M中反应并达到平衡,X的平衡转化率为50%,则该温度为________℃。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)。
PCl3(g)+Cl2(g)。
编号 | 温度 /℃ | 起始物质 的量/mol | 平衡物质 的量/mol | 达到平衡 所需时间/s | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t |
Ⅱ | 320 | 0.80 | t1 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t2 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ
C.反应到达平衡时,容器Ⅰ中的平均速率为v(PCl5)=![]() mol·L-1·s-1
mol·L-1·s-1
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目: 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如图所示:

已知:
i. 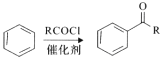
ii. ![]()
![]()
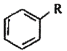
iii.RCOOH![]() RCOCl(R表示烃基或芳基)
RCOCl(R表示烃基或芳基)
(1)反应①的反应类型是_______________。
(2)B的结构简式___________。
(3) ![]() 的名称_____________。
的名称_____________。
(4)C的核磁共振氢谱中显示峰的面积之比为_________________。
(5)反应③的化学方程式__________。
(6)F的分子式是C24H28O2,F中含有的官能团名称____________。
(7)写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或![]() 结构)__________、____________。
结构)__________、____________。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(8)已知: ![]() (R、R′表示烃基或芳基)。以2-溴丙烷和乙二醇为原料,选用必要的无机试剂合成
(R、R′表示烃基或芳基)。以2-溴丙烷和乙二醇为原料,选用必要的无机试剂合成![]() ,写出合成路线________。
,写出合成路线________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氧磷(POCl3)是一种重要的化工原料,常用作半导体掺杂剂。实验室制取POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。采用氧气氧化液态PCl3法,实验装置(加热及夹持装置省略)及相关信息如下:
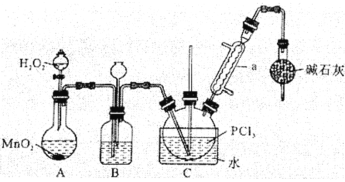
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -112.0 | 76.0 | 137.5 | 均为无色液体;遇水均剧烈水解为含氧酸和氯化氢;两者互溶。 |
POCl3 | 2.0 | 106.0 | 153.5 |
(1)仪器a的名称为______。
(2)装置C中生成POCl3的化学方程式为__________。
(3)装置B的作用除观察O2的流速之外,还有_________、________。
(4)反应温度应控制在60-65℃之间,原因是__________。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①实验Ⅰ结束后,待三颈烧瓶中液体冷却到室温,准确称取16.725gPOCl3,产品,置于盛60.00mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00mL溶液。
②取10.00mL溶液于锥形瓶中,加入10.00mL3.2mol·L-1AgNO3溶液,使氯离子完全沉淀;向其中加入少量硝基苯并用力摇动。
③以硫酸铁溶液为指示剂,用0.2 mol·L-1KSCN溶液滴定过量的AgNO3溶液,达滴定终点时共用去10.00mLKSCN溶液。
己知:Ag++SCN-=AgSCN↓;Ksp(AgCl)>Ksp(AgSCN)。
(5)达滴定终点时的现象为____________。
(6)实验过程中加入硝基苯的目的是__________;若无此操作,则所测POCl3的含量将____________(填“偏高”、“偏低”或“不变”)。
(7)测得产品POCl3的百分含量为________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com