
科目: 来源: 题型:
【题目】下列关于有机物![]() 的叙述不正确的是( )
的叙述不正确的是( )
A.该物质在一定的条件下能形成高分子化合物
B.分子中最多有15个原子位于同一平面内
C.1mol该有机物可与4 molH2发生加成反应
D.该物质能使溴水褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】铜与锌用导线连接后,插入稀硫酸中形成原电池。
(1)分析图并填空:__。
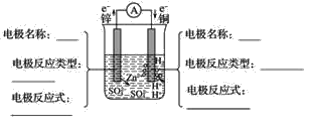
(2)原电池总反应式(离子方程式)__。
(3)上述装置产生电流的原因是__。
(4)上述装置的能量转化是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
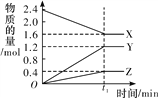
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】碳元素是形成单质及其化合物种类最多的元素。回答下列问题:
(1)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为_________,其中C原子的杂化方式为__________,该物质易溶于水的主要原因是_______________。
(2)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为_______;CO可以和很多过渡金属形成配合物,如Ni(CO)4,写出基态Ni原子的电子排布式__________。
(3)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为__________

(4)图②为碳的一种同素异形体C60分子,每个C60分子中含有σ键的数目为________。
(5)图③为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0,1/2),C为(1/2,1/2,0);则D原子的坐标参数为__________。
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是___________g·㎝-3(列出计算式即可,阿伏加徳罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃时某些弱酸的电离平衡常数(如下表)。下面图象表示常温下稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )

A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO![]()
C.图象中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的浓度大于b点酸的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在做原电池原理的实验时,有如下实验步骤:
①用导线将灵敏电流计的两端分别与纯净的锌片和铜片相连接(如图1);
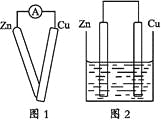
②把一块纯净的锌片插入盛有稀硫酸的烧杯中;
③把一块纯净的铜片插入盛有稀硫酸的烧杯中;
④用导线把锌片和铜片连接起来后,再平行地插入盛有稀硫酸的烧杯中(如图2)。
回答下列问题:
(1)实验步骤①中应观察到的现象是_______________________。
(2)实验步骤②中应观察到的现象是_______________________。
(3)实验步骤③中应观察到的现象是_______________________。
(4)实验步骤④中应观察到的现象是_______________________。
(5)通过实验步骤④该同学头脑中有了一个猜想(或假设),该猜想是_______。
(6)为了证实该猜想,该同学又设计了第⑤步实验,请简要画出第⑤步实验的装置示意图。______
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,主要以碘化物形式存在。有一化学课外小组用海带为原料制取少量碘单质,他们将海带灼烧成灰,用水浸泡一段时间(碘化物充分溶解在水中),得到海带灰悬浊液,然后按以下实验流程提取单质碘:(已知:2I-+Cl2=2Cl-+I2)
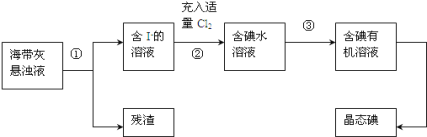
(1)指出提取碘的过程中有关的实验操作名称:①______,③ _____。
(2)过程②中充入适量Cl2的目的是(用方程式解释)_________________,把溶液中的I-转化成I2。
(3)操作③中所用的有机试剂可以是______________(只填一种)。
(4)操作过程③可以分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL有机溶剂加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层液体;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽与漏斗上口的小孔对准;
H.静置、分层。
过程③正确操作步骤的顺序是:(填编号字母)_______→________→________→A→H→________→E→F。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷(或氢气、一氧化碳等可燃性气体)和氧气构成燃料电池,则通入甲烷气体的一极是原电池的____极,该极的电极反应式是____,电池工作时的总反应的离子方程式是_____。
(2)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极气体,空气与CO2的混合气体为正极气体,制得650 ℃下工作的燃料电池,完成下列反应式:
正极:_______,
负极:2CO+2CO32--4e-=4CO2。
总反应:______。
(3)铅蓄电池放电时,总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,由此可以判断:
①原电池的电极材料:负极:__。
②电极反应式:正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O,负极反应式为_______。
③工作后,铅蓄电池里电解质溶液的pH____(填“变大”“变小”或“不变”),理由是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com