
科目: 来源: 题型:
【题目】如图所示标出的是元素周期表的一部分元素,据图回答下列问题。
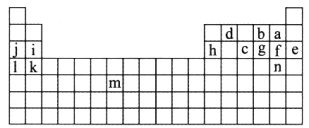
(1)图中用字母标出的14种元素中,化学性质最不活泼的是________(用元素符号表示,下同),金属性最强的是________,非金属性最强的是________,常温下单质为液态的非金属元素是________________,属于过渡元素的是________(本空用图中字母表示)。
(2)b、f、c气态氢化物的化学式分别为________、________、________,其中热稳定性最弱的是______。
(3)图中第三周期元素中原子半径最小的是________(稀有气体元素除外)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出电子式:KOH________________________;CO2_______________________
(2)用电子式表示下列化合物的形成过程:CaF2:___________________________________
H2S:____________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3工艺流程如图所示:

已知:酸化反应产物有KH(IO3)2、Cl2和KCl
(1)“酸化反应”所需I2从海带中提取。经历灼烧海带,浸泡海带灰等步骤,向获得的I-溶液加入MnO2,在酸性条件下生成I2,其离子反应方程式为___。
(2)酸化产物KH(IO3)2所含化学键有___,“调pH”中发生反应的化学方程式为___。
(3)已知KIO3在水中随温度升高而增大,则浓缩结晶的具体步骤是___。
(4)KIO3也可采用“电解法”制备,装置如图所示。

①KOH与I2制备KIO3的离子反应方程式为___。
②电解时阳极的电极反应式:___;阴极的电极反应式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X的结构简式如图所示。下列说法错误的是( )
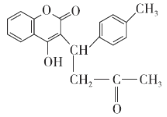
A.有机物X的分子式为C20H18O4
B.1 mol有机物X最多可以和8 mol H2加成
C.1 mol有机物X最多消耗2 mol NaOH
D.分子中没有手性碳
查看答案和解析>>
科目: 来源: 题型:
【题目】绿色化学,体现了人类可持续发展的客观要求。尿素电氧化法在碱性条件下将工业废水和生活污水富含的尿素转化为对环境无害的物质,并将化学能转化电能(图1),由尿素电氧化法产生的电能可供治理硫化氢(图2)。
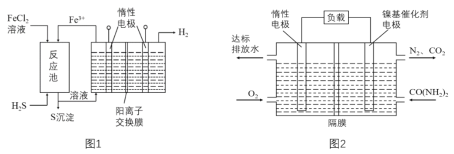
(1)写出CO(NH2)2的电子式:___。
(2)尿素电氧化法负极发生的反应为:___,隔膜为___(填“阴”或“阳”)离子交换膜。
(3)先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,见图1。
①处理掉废水中尿素,消耗22.4L O2(标准状况下)时,可供治理硫化氢,产生___gS沉淀;电解池的溶液中,溶质是___。
②阳极的电极反应式为___。
③电解总反应的离子方程式是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:2CH3CH2OH![]() CH3CH2OCH2CH3+H2O。
CH3CH2OCH2CH3+H2O。
(乙醚制备)装置设计如图(部分装置略)
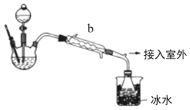
(1)仪器b应更换为下列的___(填序号)。
A.干燥器 B.直形冷凝管 C.玻璃管 D.安全瓶
(2)反应温度控制在145℃,还需添加___以防止局部过热,若温度过高,会生成一种能催熟果实的气体,则副反应化学方程式为:___。
(3)反应时,若滴入乙醇的速率显著超过馏出液速率,反应速率会降低,可能原因是___。
(乙醚提纯)
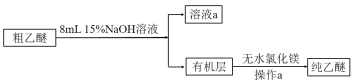
(4)粗乙醚中含有的主要杂质为___;操作a的名称是___;无水氯化镁的作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知M是短周期金属元素,X和Y是短周期非金属元素,且X、M、Y的原子序数依次增大。三者组成的物质 M3XY(可视为M2X MY)是一种良好的离子导体。研究者在常压下利用下列反应合成M3XY:2M +2MXA + 2MY==2M3XY + A2。其中常温常压下A2是无色无味气体,已知上述反应中消耗0.92 g M的单质可得到标准状况下448 mL的A2。下列有关说法正确的是( )
A.X位于第二周期第IVA族
B.简单离子半径:Y > M > X
C.MXA是共价化合物
D.M3XY溶于水后溶液呈碱性
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1∶2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。下列叙述正确的是( )
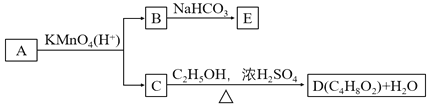
A.B的结构简式为HOOCCH2CH2OHB.D有6种同分异构体
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目: 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
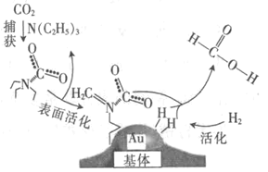
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是( )
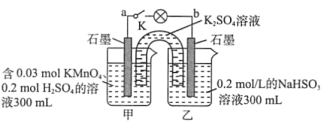
A.电池工作时,甲烧杯发生的反应为MnO4-被还原生成MnO2
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.乙中电极反应为HSO3--2e-+H2O=SO42-+3H+
D.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com