
科目: 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,2mol X和3mol Y进行反应:X(g)+Y(g)![]() Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.05 mol/(Ls)
B. 其他条件不变,增大X的浓度,平衡右移,X的转化率增大
C. 其他条件不变,12s后将容器体积扩大为10L,Z的平衡浓度变为0.06mol/L
D. 其他条件不变,若移走1molX和1.5molY,再达平衡时Z的物质的量小于0.3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在1.0 L恒容密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)![]() Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
Y(g)+Z(g) ΔH<0,容器内气体总压强p随反应时间t的变化关系如图所示。以下分析正确的是 ( )
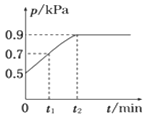
A. 该温度下此反应的平衡常数K=3.2
B. 从反应开始到t1时的平均反应速率v(X)=0.2/t1 mol·L-1·min-1
C. 欲提高平衡体系中Y的百分含量,可加入一定量的X
D. 其他条件不变,再充入0.1 mol气体X,平衡正向移动,X的转化率减少
查看答案和解析>>
科目: 来源: 题型:
【题目】图是某条件下N2与H2反应过程中能量变化的曲线图。下列叙述正确的是( )
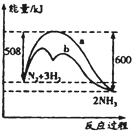
A. 该反应的热化学方程式为:N2+3H2![]() 2NH3 △H=-92kJ·mol-1
2NH3 △H=-92kJ·mol-1
B. 正反应的活化能大于逆反应的活化能
C. b曲线是加入催化剂时的能量变化曲线
D. 使用催化剂后反应的焓变减小,N2转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语书写正确的是( )
A. 次氯酸的电离方程式:HClO===H++ClO-
B. 铝溶于烧碱溶液的离子方程式:Al+2OH-==AlO2-+H2↑
C. 电解精炼铜的阴极反应式:Cu-2e-==Cu2+
D. 已知中和热为57.3 kJ·mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH(aq)==Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是( )
A.硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂
B.厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大
C.酒精能使蛋白质变性,预防新冠肺炎病毒使用的酒精纯度越高越好
D.使用氯气对自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:
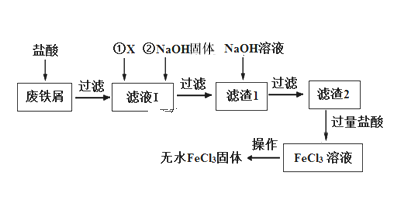
已知:氢氧化物的Ksp如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X可以选用下列物质中的____(选填序号)
A.NaCl B.FeCl3 C.H2O2 D.H2SO4
(2)滤液Ⅰ加入NaOH固体的目的是调节溶液的pH(忽略加入NaOH固体以后溶液体积的变化)。已知滤液Ⅰ中c(Fe3+)为1.0 mol·L-1,c(Al3+)为0.03 mol·L-1,c(Mg2+)为0.01 mol·L-1,当Fe3+恰好沉淀完全时[c(Fe3+)=1×10-5 mol·L-1],Al3+是否已经开始沉淀______(填“是”或“否”)。
(3)写出滤渣1加NaOH溶液发生反应的离子方程式_____________________。
(4)生产流程中最后“从FeCl3溶液得到无水FeCl3固体”的操作分为两步:第一步,先冷却结晶得到FeCl3·6H2O晶体;第二步,制无水FeCl3固体。第二步的正确操作是_____。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是____________________(用离子方程式表示)
②通过控制条件生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
Fex(OH)y(3x-y)++yH+,欲增加聚合氯化铁的产率可采取的方法是_____(填字母)。
a.降温 b.加氨水 c.加入NH4Cl d.加入NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可制得硫酸铜晶体(装置如图1、2所示)。


(1)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是_______________。
(2)图1烧瓶中发生反应的离子方程式为_____________________________________。
(3)图2是图1的改进装置,其优点除可以防止倒吸外还有:____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。

(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
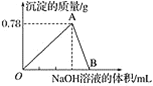
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
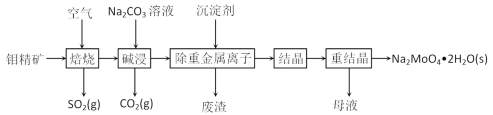
(1)提高焙烧效率的方法有:_____________(写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________。氧化产物是________________。
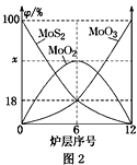
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________。
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为 ______________________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com