
科目: 来源: 题型:
【题目】下列化学(或离子)方程式中,不能正确表达反应颜色变化的是
A.电解饱和食盐水产生黄绿色气体:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.红热木炭遇浓硝酸产生红棕色气体:C+4HNO3(浓) ![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向Ca(ClO)2溶液中通入少量SO2,出现白色沉淀SO2+Ca2++3ClO+H2O=CaSO4↓+2HClO+Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下四个反应,请写出盐酸在三个反应中,分别表现什么性质:
①Zn+2HCl=ZnCl2+H2↑________;
②NaOH+HCl=NaCl+H2O________;
③2HCl![]() H2↑+Cl2↑________;
H2↑+Cl2↑________;
④KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O________。方程式中氧化剂与还原剂的物质的量之比为________,若有5mol还原剂被氧化,则生成的Cl2为________ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.标准状况下,2.24LHF中含有的极性键数目为0.1NA
B.18g重氢氨基(-ND2)中含有的电子数为10NA
C.33.6L氯气与足量铝充分反应,转移电子数为3NA
D.7g乙烯和丙烯混合气体中的氢原子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】铬鞣剂[Cr(OH)SO4]可用于提高皮革的耐曲折强度。一种以铬渣(含Cr2O3及少量Fe2O3、CaO、Al2O3、SiO2等杂质)为原料制备Cr(OH)SO4的工艺流程如图:

回答下列问题:
(1)“焙烧”时发生的主要的化学方程式为__。
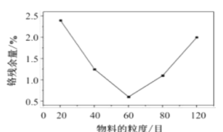
(2)“水浸”过程中,物料的粒度(颗粒大小)对铬残余量的影响如图所示,则最佳反应条件为__。
(3)“滤渣2”主要成分为Al(OH)3和__(填化学式),“过滤2”后,将溶液pH调至a(a小于6.5),发生的离子反应为__,若1L所得溶液中含铬元素的质量为28.6g,![]() 有
有![]() 转化为
转化为![]() 。酸化后所得溶液中c(
。酸化后所得溶液中c(![]() )=__。
)=__。
(4)根据有关国家标准,含![]() 的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含
的废水要经化学处理,使其浓度降至5.0×107mol·L1以下才能排放。含![]() 的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
的废水处理通常可用沉淀法:加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×1010],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于__mol·L1,后续废水处理方能达到国家排放标准。
(5)已知CH3OH在酸性条件下可被氧化生成CO2,写出Na2Cr2O7与CH3OH反应生成Cr(OH)SO4的化学方程式__。
(6)某厂用m1kg的铬渣(含Cr2O340%)制备Cr(OH)SO4,最终得到产品m2kg,则产率为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物M是合成抗病毒药品洛匹那韦的一种重要中间体。其合成路线如下(其中Ph表示苯基):

回答下列问题:
(1)物质A的化学名称是_______________
(2)反应①所需的试剂和条件是 ______________;反应⑤所属的反应类型为__________________
(3)F中含氧官能团的名称是_______________
(4)反应②的化学反应方程式为______________
(5)有机物X是C的同分异构体,写出满足下列条件的X结构简式为_______________
①苯环上有三个取代基
②分子结构中含有硝基
③核磁共振氢谱有4组峰,峰面积之比为6:2:2:1
(6)写出以![]() 和CH3CN为原料,制备
和CH3CN为原料,制备 的合成路线(无机试剂任选)。_______________
的合成路线(无机试剂任选)。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关有机物分子的叙述不正确的是( )
A. 乙烯分子中有一个sp2-sp2σ键和一个p-p π键
B. 乙炔每个碳原子都有两个未杂化的2p轨道,它们之间可形成两个π键
C. 乙烷两个C原子均是sp3杂化,分子中一共有6个σ键
D. 苯分子每个碳原子均是sp2杂化
查看答案和解析>>
科目: 来源: 题型:
【题目】一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①写出基态Mn原子的价电子排布式为___________________________。在元素周期表中,该元素在________(填“s”“p”“d”“f”或“ds”)区。与Mn同周期的所有过渡元素的基态原子中,最外层电子数与Mn不同的元素有__________种。
②CO32-的空间构型是__________________(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为___________________________________。
②CO2分子中C原子轨道的杂化类型为________________________________________。
③1 mol甲醛(HCHO)分子中含有的σ键数目为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知短周期元素的离子,![]() ,
,![]() ,
,![]() ,
,![]() 都具有相同的电子层结构,则下列叙述正确的是
都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数D>C>B>A
C. 离子半径C>D>B>A D. 单质的还原性A>B>D>C
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。

(实验一)碘含量的测定。取0.0100mol/L的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
回答下列问题:
(1)实验中“灼烧”是在__(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为__mL,计算得海带中碘的质量百分含量为__%。
(实验二)碘的制取。另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
(4)“适量O2”中能代替O2的最佳物质对应的电子式为__
(5)若要测定“I2+水溶液”中碘的含量,可以选择__作指示剂,用Na2S2O3溶液滴定,滴定终点的现象是__。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为__(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com