
科目: 来源: 题型:
【题目】常温下,向20 mL x mol·L-1 CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图所示(忽略温度变化)。下列说法中不正确的是( )
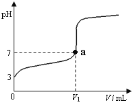
A. 上述 CH3COOH溶液中:c(H+)=1×10-3 mol·L-1
B. 图中V1 <20 mL
C. a点对应的溶液中:c (CH3COO-)=c (Na+)
D. 当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-)
查看答案和解析>>
科目: 来源: 题型:
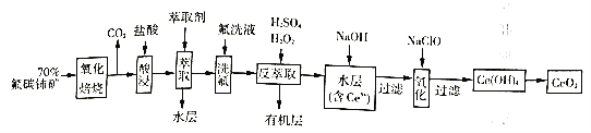
【题目】二氧化铈(![]() )是一种重要的稀土化合物。以氟碳铈矿(主要含
)是一种重要的稀土化合物。以氟碳铈矿(主要含![]() )为原料制备
)为原料制备![]() 的一种工艺流程如图:
的一种工艺流程如图:
已知:①![]() 能与
能与![]() 结合成
结合成![]() ,也能与
,也能与![]() 结合成
结合成![]() ;②
;②![]() 在硫酸体系中能被萃取剂
在硫酸体系中能被萃取剂![]() 萃取,而
萃取,而![]() 不能。回答:
不能。回答:
(1)“氧化培烧”前需将矿石粉碎成细颗粒,其目的是_________。
(2)“酸浸”中会产生大量黄绿色气体,写出![]() 与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
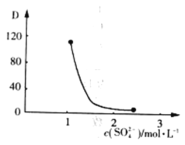
(3)“萃取”时存在反应:![]() 。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示
。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示![]() (Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比
(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比![]() 。保持其它条件不变,在起始料液中加入不同量的
。保持其它条件不变,在起始料液中加入不同量的![]() 以改变水层中的
以改变水层中的![]() ,D随起始料液中
,D随起始料液中![]() 变化的原因:_____________。在
变化的原因:_____________。在![]() 的条件下,取
的条件下,取![]() 含四价铈总浓度为
含四价铈总浓度为![]() 的酸浸液,向其中加入
的酸浸液,向其中加入![]() 萃取剂
萃取剂![]() ,充分振荡,静置,水层中
,充分振荡,静置,水层中![]() _________。(结果保留二位有效数字)。
_________。(结果保留二位有效数字)。
(4)“反萃取”中,在稀硫酸和![]() 的作用下
的作用下![]() 转化为
转化为![]() 。
。![]() 在该反应中作用与下列反应中
在该反应中作用与下列反应中![]() 的作用相同的是________。
的作用相同的是________。
A.![]() 处理含酸性重铬酸钾的废水
处理含酸性重铬酸钾的废水
B.![]() 和二氧化锰混合制氧气
和二氧化锰混合制氧气
C.![]() 与氧化钙制过氧化钙
与氧化钙制过氧化钙
D.![]() 在海带提碘实验中的作用
在海带提碘实验中的作用
(5)“氧化”步骤的化学方程式为:___________。
(6)取上述流程中得到的![]() 产品
产品![]() ,加硫酸溶解后,用
,加硫酸溶解后,用![]() 溶液滴定至终点时(铈被还原为
溶液滴定至终点时(铈被还原为![]() ,其他杂质均不反应,
,其他杂质均不反应,![]() 为无色),用
为无色),用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,消耗
,消耗![]() 标准溶液。该产品中
标准溶液。该产品中![]() 的质量分数为________。
的质量分数为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛矿工业中的硫酸酸性废水富含Ti、Fe等元素,其综合利用如下:

已知:TiO2+易水解,只能存在于强酸性溶液中。
(1)TiO2+钛的化合价为________________________。
(2)步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是________________________。
(3)操作a是蒸发浓缩、冷却结晶、______________________________________________。
(4)步骤Ⅲ中发生反应的化学方程式为________________________;反应温度一般需控制在35℃以下,其目的是____________________________________。
(5)已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中________(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3,除了适当的温度外,还需要采取的措施是_________________。
(6)向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2 nH2O。请结合原理和化学用语解释其原因_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】传统中药“金银花”中抗菌杀毒的有效成分是“绿原酸”。某高中化学创新兴趣小组运用所学知识并参考相关文献,设计了一种“绿原酸”的合成路线如图:
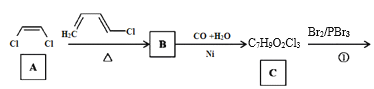
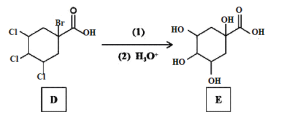
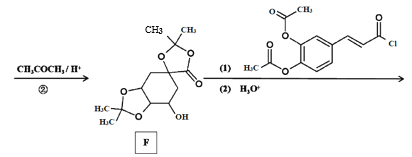
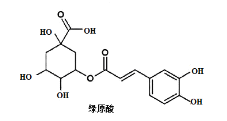
已知:① ;
;
②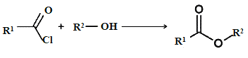 。
。
回答下列问题:
(1)有机物A的名称是___,A→B的反应类型___。
(2)C的结构简式___,有机物F中官能团的名称是___。
(3)若碳原子上连有4个不同的原子或基团时,该碳原子称为手性碳。用星号(*)标出E中的手性碳: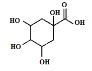 ___。
___。
(4)反应②的目的是__,写出D→E中第(1)步的反应方程式___。
(5)绿原酸在碱性条件下完全水解后,再酸化,得到的芳香族化合物的同分异构体有多种,满足以下条件的有___种(不考虑立体异构,任写一种)。
a.含有苯环
b.1mol该物质能与2molNaHCO3反应
写出核磁共振氢谱显示峰面积之比为3:2:2:1的结构简式为__。
(6)参照上述合成方法,设计由丙酸为原料制备高吸水性树脂聚丙烯酸钠的合成路线___(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚(DME)被誉为“21世纪的清洁燃料”。由合成气制备二甲醚的主要原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=90.7 kJ·mol1
CH3OH(g) △H1=90.7 kJ·mol1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
CH3OCH3(g)+H2O(g) △H2=23.5 kJ·mol1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=41.2 kJ·mol1
CO2(g)+H2(g) △H3=41.2 kJ·mol1
回答下列问题:
(1)则反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
CH3OCH3(g)+CO2(g)的△H=___________kJ·mol1。
(2)反应②达平衡后采取下列措施,能提高CH3OCH3产率的有___________。
A.加入CH3OH B.升高温度 C.增大压强 D.移出H2O E.使用催化剂
(3)以下说法能说明反应3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
CH3OCH3(g)+CO2(g)达到平衡状态的有___________。
A.H2和CO2的浓度之比为3∶1
B.单位时间内断裂3个H—H同时断裂1个C=O
C.恒温恒容条件下,气体的密度保持不变
D.恒温恒压条件下,气体的平均摩尔质量保持不变
E.绝热体系中,体系的温度保持不变
(4)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如图所示:
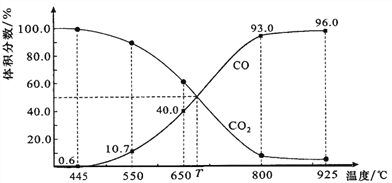
已知:气体分压(p分)=气体总压(p总)×体积分数。
①该反应△H_____0(填“>”、“<”或“=”),550 ℃时,平衡后若充入惰性气体,平衡__________(填“正移”、“逆移”或“不移动”)。
②650 ℃时,反应达平衡后CO2的转化率为_____________(保留2位有效数字)。
③T时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=_________p总。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
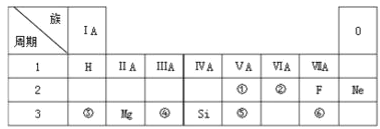
(1)②表示的元素是 ______ (填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是______ (填元素符号),其非金属性较强的是 ______ (填元素符号),其最高正价氧化物水化物酸性较强的酸是 ______ (填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
(4)②与⑥元素的氢化物的稳定性:______大于______(填分子式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】叠氮化钠(NaN3)是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①关闭止水夹K2,打开止水夹K1,开始制取氨气。
②加热装置A中的金属钠,使其熔化并充分反应后,停止通入氨气并关闭止水夹K1。
③向装置A中的b容器内充入加热介质,并加热到210~220℃,然后打开止水夹K2,制取并通入N2O。
请回答下列问题:
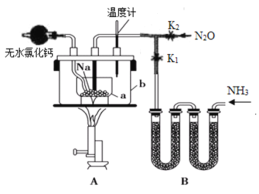
(1)制取氨气可选择的装置是__(填序号,下同),N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是__。
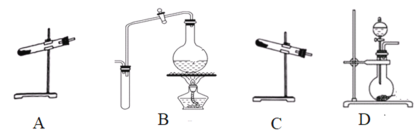
(2)步骤①中先通氨气的目的是__,步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__,步骤③中最适宜的加热方式为___。
(3)生成NaN3的化学方程式为___。
(4)反应完全结束后,进行以下操作,得到NaN3固体:
a中混合物![]() NaN3固体
NaN3固体
已知NaNH2能与水反应生成NaOH和氨气。操作Ⅱ的目的是___,操作Ⅳ最好选用的试剂是___。
(5)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500g试样配成500.00mL溶液。②取50.00mL溶液置于锥形瓶中,加入50.00mL0.1010mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8mL浓硫酸,滴入3滴邻菲啰啉指示剂,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑、Ce4++Fe2+=Ce3++Fe3+,试样中NaN3的质量分数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
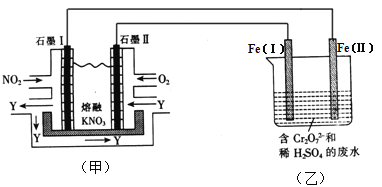
(1)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨Ⅱ是电池的 极;石墨Ⅰ附近发生的电极反应式为 。
(2)工作时,甲池内的NO3-离子向 极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,消耗的O2和NO2的体积比为 。
(3)乙池中Fe(Ⅰ)棒上发生的电极反应为 。
(4)若溶液中减少了0.01 mol Cr2O72-,则电路中至少转移了 mol电子。
(5)向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=1.0×10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至 。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种Ru配合物与g—C3N4复合光催化剂将CO2还原为HCOOH的原理示意图如图。
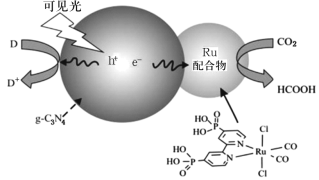
(1)Ru基态原子价电子排布式为4d75s1,写出该元素在元素周期表中的位置___,属于___区。
(2)HCOOH中σ键与π键的数目之比是___,HCOOH的沸点比CO2高的原因___。
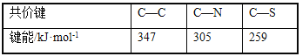
(3)紫外光的光子所具有的能量约为399kJ·mol1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因__。
(4)已知![]() 和
和![]() 中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
中所有原子均共面,其中氮原子较易形成配位键的是___(填“前者”或“后者”)。
(5)下列状态的氮、氧原子中,电离最外层一个电子所需能量最大的是___(填序号,下同),最小的是___(填序号)。
A.氮![]()
B.氧![]()
C.氧![]()
D.氧![]()
(6)一种类石墨的聚合物半导体g—C3N4,其单层平面结构如图1,晶胞结构如图2。

①g—C3N4中氮原子的杂化类型是__;
②根据图2,在图1中用平行四边形画出一个最小重复单元___;
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部,设阿伏加德罗常数的值为NA,则g—C3N4的密度为__g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是
A.原子半径由小到大的顺序为![]()
B.X的简单氢化物的热稳定性比W的强
C.化合物YX、![]() 、
、![]() 中化学键的类型相同
中化学键的类型相同
D.W的最高价氧化物对应水化物的酸性比Z的弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com