
科目: 来源: 题型:
【题目】在不同浓度、温度条件下,蔗糖水解的瞬时速率如表。下列判断不正确的是
c/mol·L-1 v/mmol·L-1·min-1 T/K | 0.600 | 0.500 | 0.400 | 0.300 |
318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
328.2 | 9.00 | 7.50 | a | 4.50 |
b | 2.16 | 1.80 | 1.44 | 1.08 |
A.a=6.00
B.b<318.2
C.不同温度时,蔗糖浓度减少一半所需的时间不同
D.同时改变反应温度和蔗糖的浓度,蔗糖水解的瞬时速率一定改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质之间有如下反应关系:
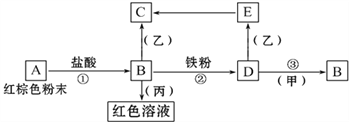
已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色。
回答:
(1) 写出下列物质的化学式:A______B______D________甲_______乙_______丙__________
(2) 写出E→C反应的化学方程式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中发生的反应的化学方程式是________。
(2)画出虚线框内的实验装置图,所加试剂为____________,该装置的作用是_______。
(3)装置B中盛放的试剂是____________(填序号),实验现象为____________,该反应的离子方程式是_____________,该反应属于四种基本反应类型中的__________反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________(填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】四溴化乙炔(CHBr2-CHBr2)是一种无色液体,常用于合成季铵化合物.某同学在实验室模仿工业生产,以电石(主要成分CaC2,少量CaS,Ca3P2,Ca3As2等)和Br2等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示.已知:四溴化乙炔的熔点为1℃,沸点为244℃,密度为2.967g·cm-3,难溶于水.回答下列问题:
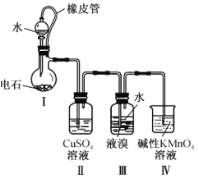
(1)装置Ⅰ中CaC2与水反应生成乙炔(C2H2)和氢氧化钙,写出该反应的化学方程式:__________________;该反应剧烈,为了得到平缓的C2H2气流,可采取的措施是____________(任写一条).
(2)装置Ⅱ的目的是_________________________________________
(3)装置Ⅲ中在液溴液面上加入一层水的目的是__________________________;装置Ⅲ中表明已反应完成的现象是______________________________________________________;已知装置Ⅲ反应后的体系含有多种物质,简述获得纯净四溴化乙炔的操作:________________________________________________
(4)装置Ⅳ的目的是除去未反应的乙炔.在碱性条件下,KMnO4与C2H2反应生成碳酸盐和MnO2,则该反应中参与反应的氧化剂和还原剂的物质的量之比为____________。
(5)实际工业生产中会产生大量的副产物Ca(OH)2,用于制备漂白粉,写出制备漂白粉的化学方程式: _____________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
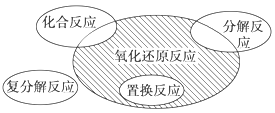
A.Cl2+2KBr=Br2+2KClB.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3D.2Na2O2+2CO2=2Na2CO3+O2
查看答案和解析>>
科目: 来源: 题型:
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
查看答案和解析>>
科目: 来源: 题型:
【题目】(I)某原料经测定主要含有A、B、C、D四种原子序数依次增大的短周期元素,其相关信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为__________________________________
(2)![]() 常用作除锈剂,该分子中B的杂化方式为_____;1 mol
常用作除锈剂,该分子中B的杂化方式为_____;1 mol ![]() 分子中含有σ键与π键的数目之比为_____。
分子中含有σ键与π键的数目之比为_____。
(3) ![]() 分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O![]() (橙色)+CH3CH2OH
(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(4)基态Cr 原子的价电子排布图为__________________________________
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为________________。
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
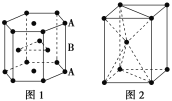
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为_____________________,配位数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关能量转化的说法不正确的是
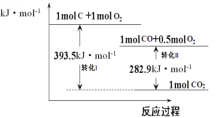
A.25℃时,碳的标准燃烧热:△H=-393.5kJ·mol-1
B.转化II的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=-565.8kJ·mol-1
C.在反应C(s)+O2(g)=CO2(g)中,反应物的总键能大于生成物的总键能
D.由碳转化为一氧化碳的热化学方程式为:2C(s)+O2(g)=2CO(g)△H=-221.2kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1L0.lmol·L-1Na2CO3溶液中含有CO32-数目小于0.1NA
B.Na2O2与CO2反应,每生成1molO2转移的电子数为NA
C.标准状况下,2.24L乙醇中含共价键数目为0.8NA
D.常温常压下,18gH218O含有10NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
(I)汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:![]()
![]()
![]()
![]()
若某反应的平衡常数表达式为![]() ,则此反应的热化学方程式为_______。
,则此反应的热化学方程式为_______。
(2)![]() 在一定条件下可发生分解:
在一定条件下可发生分解:![]() ,一定温度下,在恒容密闭容器中充入一定量
,一定温度下,在恒容密闭容器中充入一定量![]() 进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
进行该反应,能判断反应已达到化学平衡状态的是_____(填字母)。
a. ![]() 和
和![]() 的浓度比保持不变 b.容器中压强不再变化
的浓度比保持不变 b.容器中压强不再变化
c. ![]() d. 气体的密度保持不变
d. 气体的密度保持不变
(Ⅱ)甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。 CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(3)将![]() 和
和![]() 按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成
按物质的量之比1:3充入体积为2.0L的恒容密闭容器中反应生成![]() ,如图1表示压强为0.1 MPa和5.0 MPa下
,如图1表示压强为0.1 MPa和5.0 MPa下![]() 转化率随温度的变化关系。
转化率随温度的变化关系。
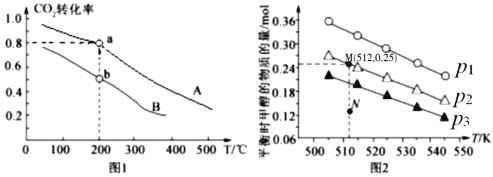
①a、b两点化学反应速率分别用![]() ,表示,则
,表示,则![]() _____
_____![]() (填“大于”、“小于”或“等于”)
(填“大于”、“小于”或“等于”)
②列出a点对应的平衡常数表达式K= ____________________。
(4)在1.0 L恒容密闭容器中投入1 mol ![]() 和2.75 mol
和2.75 mol ![]() 发生反应:
发生反应:![]() CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
CH3OH(g) + H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图2所示,下列说法正确的是________。
A.该反应的正反应为放热反应
B.压强大小关系为P1<P2<P3
C.M点对应的平衡常数K的值约为![]()
D.在![]() 及512 K时,图中N点
及512 K时,图中N点![]()
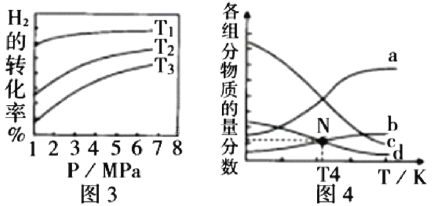
(5)![]() 催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g)
催化加氢合成乙醇的反应为:2CO2(g) + 6H2(g) ![]() C2H5OH(g) + 3H2O(g)
C2H5OH(g) + 3H2O(g) ![]() ;m代表起始时的投料比,即
;m代表起始时的投料比,即![]() 。
。
① 图3中投料比相同,温度![]() ,则该反应的焓变
,则该反应的焓变![]() _______0(填
_______0(填![]() )。
)。
② m=3时,恒压条件下各物质的物质的量分数与温度的关系如图4所示,则曲线b代表的物质为_________(填化学式)。
(6)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图5所示。离子交换膜a为 ______(填“阳膜”、“阴膜”),阳极的电极反应式为_______________________________________

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com