
科目: 来源: 题型:
【题目】将1molM和2 molN置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)![]() P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )
P(g)+Q(g) △H。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的是( )

A. 若X、Y两点的平衡常数分别为K1、K2,则K1>K2
B. 温度为T1时,N的平衡转化率为80%,平衡常数K=40
C. 无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态
D. 降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
B. 由实验数据可知该反应较适宜的温度为T1
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
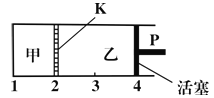
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
查看答案和解析>>
科目: 来源: 题型:
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是_________;
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:___________,在该反应中氧化产物是_________,还原产物是____________。
(3)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。其反应原理为(用化学方程式表示):_________。
(4)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用:
①该同学应称取NaOH固体__________ g;
②上述实验除了需要托盘天平、药匙、烧杯、玻璃棒、量筒等仪器外,还需要的仪器有_______。
③下列操作使配制的NaOH溶液浓度偏低的有__________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量
B.定容的仰视刻度线
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(5)取上述配制的NaOH溶液______ L才能与0.224 L 氯气(标准状况下)恰好完全反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)写出下列基团(或官能团)的名称或结构简式:—CH2CH3_____________、—COOR_____________、碳碳双键_____________、醛基_____________。
(2)按系统命名法命名有机物CH3CH(C2H5)CH(CH3)2_____________,![]() _____________
_____________
(3)写出下列各种有机物的结构简式
①2,3-二甲基-4-乙基已烷_____________
②支链只有一个乙基且相对分子质量最小的烷烃_____________
③异戊烷(写出键线式)_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
①CH3—CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③丁二烯和丁烯为同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的庚烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥能够快速、微量、精确地测定相对分子质量的物理方法是核磁共振谱法
A.①⑤⑥B.②③④C.③⑤⑥D.④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目: 来源: 题型:
【题目】氨和水都是常用的试剂。请回答下列问题:
(1)氮元素基态原子的核外电子中,未成对电子数成对电子数之比为_____。
(2)NH3分子可结合一个H+形成铵根离子(NH4+)。
①NH3分子中N原子的杂化类型是_____。
②NH3分子中与H+结合的过程中未发生改变的是_____(填序号)。
a 微粒的空间构型 b N原子的杂化类型 c H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)6]2+→Cu(OH)2→[Cu(NH3)4]2+。 [Cu(H2O)6]2+和[Cu(NH3)4]2+中共同含有的化学键类型是_______。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则冰晶体中氢键的“键能”是_____ kJ·mol(已知冰的升华热是51 kJ·mol-1),水分子间范德华力的能量为11 kJ·mol-1);水变成冰晶体时,密度减小的主要原因是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com