
科目: 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g) ![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断不正确的是
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目: 来源: 题型:
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】我国制碱专家侯德榜先生潜心研究制碱技术,发明了侯氏制碱法。工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如下:
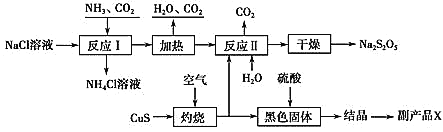
已知:反应Ⅱ包含2NaHSO3Na2S2O5+H2O等多步反应。
(1) 反应Ⅰ的化学方程式为________;在进行反应Ⅰ时,向NaCl溶液中先通入_______(填“CO2”或“NH3”);
(2)“灼烧”时发生反应的化学方程式为__________;
(3)已知Na2S2O5与稀硫酸反应放SO2,其离子方程式为__________。
(4)副产品X化学式为________;生产中可循环利用的物质为____________(化学式)。
(5)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应Ⅱ中气体与固体反应物的物质的量之比为_________,若气体量不足,则会导致___________________,检验产品中是否含有碳酸钠杂质,所需试剂是_________(填编号)。
①酸性高锰酸钾溶液 ②品红溶液 ③澄清石灰水 ④饱和碳酸氢钠溶液 ⑤NaOH溶液 ⑥稀盐酸
查看答案和解析>>
科目: 来源: 题型:
【题目】利用电解技术,以氯化氢为原料回收氯气的过程如图所示,下列说法不正确的是
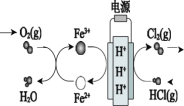
A.H+由阳极区向阴极区迁移
B.阴极电极反应:Fe3+ + e- =Fe2+
C.阴极区发生的反应有:4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O
D.阳极电极反应:2HCl + 2e- = Cl2 + 2H+
查看答案和解析>>
科目: 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将 H2O 和CO2 转化为 O2 和燃料(C3H8O)。下列说法正确的是( )
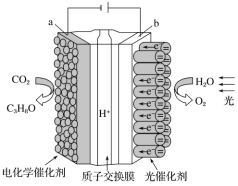
A.该装置将化学能转化为光能和电能
B.每生成 1 mol O2,有 44 g CO2 被还原
C.该装置工作时,H+从 b 极区向 a 极区迁移
D.a 电极的反应为 3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在可逆反应2A(g)+3B(g)![]() xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
xC(g)+D(g)中,已知:反应开始加入的物质只有 A、B,起始浓度 A 为 5 mol·L-1,B 为 3 mol·L-1,前 2 min C 的平均反应速率为 0.5 mol·L-1·min-1,2 min 后,测得 D 的浓度为 0.5mol·L-1,则关于此反应的下列说法中正确的是( )
A.2 min 末时 A 和 B 的浓度之比为 5∶3
B.x=1
C.2 min 末时 A 消耗的浓度为 0.5 mol·L-1
D.2 min 末时 B 的浓度为 1.5 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中可以作为2NO2(g) ![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2;②单位时间内生成n mol O2的同时生成2n mol NO;③混合气体的颜色不再改变;④混合气体的密度不再改变的状态;⑤混合气体的平均相对分子质量不再改变的状态;⑥混合气体中NO与O2的物质的量之比保持恒定;⑦混合气体中NO与NO2的物质的量之比保持恒定
A. ①③⑤⑦ B. ②④⑤ C. ①③④ D. ①②③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车常用蓄电池其结构如图所示,放电时反应如下: PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断,下列叙述中不正确的是
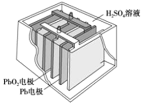
A.Pb 作为负极,失去电子,被氧化
B.电池放电时,溶液酸性增强
C.负极反应是 Pb+SO42-–2e-=PbSO4
D.PbO2 得电子,被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com