
科目: 来源: 题型:
【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
查看答案和解析>>
科目: 来源: 题型:
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
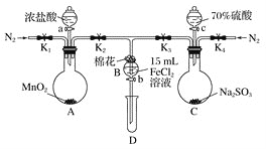
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
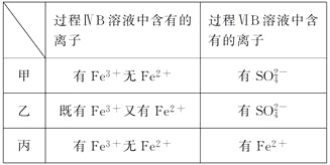
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)真空碳热还原-氧化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
3AlCl(g)═2Al(l)+AlCl3(g) △H=bkJ·mol-1
反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示);
(2)已知 2SO2(g)+O2(g)=2SO3(g)△H反应过程的能量变化如图所示,已知1mol SO2(g)氧化为1mol SO3放出99kJ的热量,请回答下列问题:
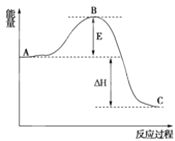
①图中A分别表示______________;
②E的大小对该反应的反应热_________(填“有”或“无”)影响;
③该反应通常用V2O5作催化剂,加V2O5会使图中B点 __________(填“升高”“降低”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将CuSO4·5H2O(s)溶于水会使溶液温度降低,将 CuSO4(s)溶于水会使溶液温度升高。则下列能量转化关系不正确的是
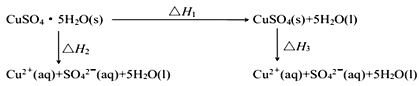
A.ΔH1>0B.ΔH2<ΔH3C.ΔH3<ΔH1D.ΔH2=ΔH1+ΔH3
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:
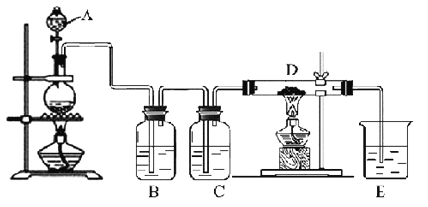
(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】将二氧化锰和生物质置于一个由滤纸制成的折纸通道内形成电池(如图所示),该电池可将可乐(pH=2.5)中的葡萄糖转化成葡萄糖内酯并获得能量。下列说法正确的是
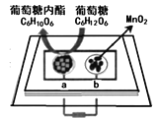
A.a极为正极
B.外电路电子移动方向为b到a
C.b极的电极反应式为:MnO2+2H2O+2e-=Mn2++4OH-
D.当消耗0.01mol葡萄糖时,电路中转移0.02mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】氨在工农业生产中应用广泛。在压强为30MPa时,不同温度时合成氨平衡混合气体中NH3的体积分数如下:
温度/℃ | 200 | 300 | 400 | 500 | 600 |
氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
请回答:
(1)根据图中所示,合成氨的热化学方程式为___。
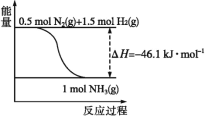
(2)将1molN2(g)和3molH2(g)通入一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___92.2kJ(填“大于”“等于”或“小于”),原因是___;若加入催化剂,ΔH___(填“变大”“变小”或“不变”)。
(3)已知破坏1molN≡N键、1molH—H键需要吸收的能量分别为946kJ、436kJ,则破坏1molN—H键需要吸收的能量为___kJ。
(4)N2H4可视为NH3分子中的一个H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,以NO2为氧化剂发生反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)=2NO2(g) ΔH1=+67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH2=-534kJ·mol-1。
则1molN2H4与NO2完全反应的热化学方程式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的氨基甲酸铵置于密闭容器中,一定条件下发生反应: H2NCOONH4(s) ![]() CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
CO2(g) + 2NH3(g) 。下列不能作为平衡状态判定依据的是
A.混合气体的密度保持不变
B.混合气体的平均摩尔质量保持不变
C.二氧化碳浓度保持不变
D.混合气体的压强保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】氨的催化氧化是工业制硝酸的重要反应:4NH3+5O2![]() 4NO+6H2O,对于该反应判断正确的是
4NO+6H2O,对于该反应判断正确的是
A. 氧气被还原B. 该反应是置换反应
C. 氨气是氧化剂D. 若有17 g氨参加反应,反应中转移10 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
(1)用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。
C2H4(g)+2H2O(g)。若该反应体系的能量随反应过程变化关系如图所示,则该反应的ΔH=___(用含a、b的式子表示)。又知:相关化学键的键能如下表所示,实验测得上述反应的ΔH=-152kJ·mol-1,则表中的x=___。

化学键 | C=O | H—H | C=C | C—H | H—O |
键能/kJ·mol-1 | 803 | 436 | x | 414 | 464 |
(2)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:
化学键 | N≡N | O | N—N | N—H | O—H |
946 | 497 | 193 | 391 | 463 |
写出1mol气态肼(H2N—NH2)燃烧生成氮气和水蒸气的热化学方程式:___。
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
①科学家提出由CO2制取C的太阳能工艺如图所示。
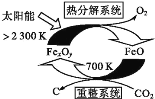
若“重整系统”发生的反应中![]() =6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
=6,则FexOy的化学式为___。“热分解系统”中每分解1molFexOy,转移电子的物质的量为___。
②工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,CH3OCH3(g)+H2O(g)=2CH3OH(g) ΔH2=+23.4kJ·mol-1,则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
CH3OCH3(g)+3H2O(g) ΔH3=___kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com