
科目: 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
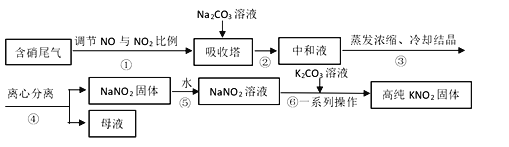
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
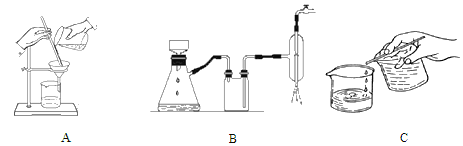
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目: 来源: 题型:
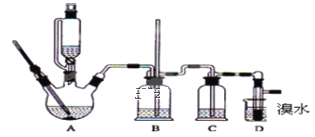
【题目】实验室用少量的溴水和足量的乙烯制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式:___________________________________。
(2)安全瓶B可以防倒吸,并可以检查实验进行时试管D是否发生堵塞.请写出发生堵塞时瓶B中的现象:______________________________________________________。
(3)在装置C中应加入_____(填字母),(a.水 b.浓硫酸 c.氢氧化钠溶液)其目的是 ___________________________________________________________________。
(4)若产物中有少量副产物乙醚,可用 ________________ 的方法除去。
(5)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 _________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以天然气为原料合成氨是现代合成氨工业发展的方向与趋势
(一)天然气与氮气为原料,以固态质子交换膜为电解质,在低温常压下通过电解原理制备氨气如图所示:
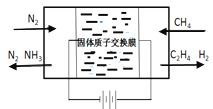
写出在阴极表面发生的电极反应式:_____________。
(二)天然气为原料合成氨技术简易流程如下:

一段转化主要发生的反应如下:
①CH4(g) +H2O(g) ![]() CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
CO(g)+3H2(g) ΔH1 = 206 kJ·molˉ1
②CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
CO2(g) + H2(g) ΔH2 = -41 kJ·molˉ1
二段转化主要发生的反应如下:
③2CH4(g)+ O2(g) ![]() 2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
2CO(g)+4H2(g) ΔH3 = -71.2 kJ·molˉ1
④2CO(g) + O2(g) ![]() 2CO2(g) ΔH4 = -282 kJ·molˉ1
2CO2(g) ΔH4 = -282 kJ·molˉ1
(1)已知CO中不含C=O,H-H的键能为436 kJ·molˉ1,H-O的键能为463 kJ·molˉ1,C-H的键能为414 kJ·molˉ1,试计算C=O的键能_________。
(2)实验室模拟一段转化过程,在800oC下,向体积为1L的恒容密闭反应器中,充入1mol的CH4与1mol的H2O,达到平衡时CH4的转化率为40%,n(H2)为1.4mol,请计算反应②的平衡常数_________。
(3)下列说法正确的是_________。
A.合成氨过程实际选择的温度约为700℃,温度过高或过低都会降低氨气平衡产率
B.上述工业流程中压缩既能提高反应速率又能提高合成氨的产率
C.二段转化释放的热量可为一段转化提供热源,实现能量充分利用
D.二段转化过程中,需严格控制空气的进气量,否则会破坏合成气中的氢氮比
(4)已知催化合成氨中催化剂的活性与催化剂的负载量、催化剂的比表面积和催化反应温度等因素有关,如图所示:

①实验表明相同温度下,负载量5%催化剂活性最好,分析负载量9%与负载量1%时,催化剂活性均下降的可能原因是________。
②在上图中用虚线作出负载量为3%的催化剂活性变化曲线_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组对液态有机物M进行如下探究实验。请回答:
Ⅰ.M组成的探究
取6.2 g有机物M在足量O2中完全燃烧后,将生成 物全部通入如图1所示装置(夹持装置略去),则:
(1)若不考虑尾气处理,该装置还有一个明显不足为____________________________。
(2)若不考虑其他因素,且生成物在A、B中全部被吸收,测得装置A增重5.4 g,装置B增重8.8 g,M的实验式为___________________,分子式为_______________________。
Ⅱ.M结构的探究
为确定M的官能团,该小组设计如图2所示装置(加持装置略)进行实验,步骤为:
①准确量取2.79 mL ρ=1.11 g·mL-1的M加入分液漏斗中;
②打开分液漏斗活塞,当M恰好全部加入a中时,迅速关闭分液漏斗活塞;
③a中反应完全后,准确读取量筒中液体体积。
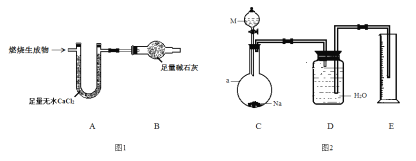
(3)a仪器的名称为__________;伸入量筒中的导管 ____(填“长”或“短”)些更合理。
(4)实验前,检验C、D部分装置气密性的方法为____________________________。
(5)第③步中,准确读取量筒读数,注意的事项为冷至室温、__________________和_____________________________。
(6)下列各项,可能导致所测气体体积偏大的为__________(填选项字母)。
A.所取M中含有少量水
B.装置C中Na过量
C.装置D、E间导管中的水没有排入量筒中
D.分液漏斗中液体M加入仪器a,将a中部分气体排入D
(7)若量筒中水的体积转化为标准状况下气体体积为560 mL,装置C中反应的化学方程式为______________________________________________(有机物用结构简式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知酸性: ![]() >H2CO3>
>H2CO3>![]() >HCO3-;现要将
>HCO3-;现要将![]() 转变为
转变为 ![]() ,可行的方法是
,可行的方法是
A.向该溶液中加入足量的稀硫酸,加热
B.将该物质与稀硫酸共热后,再加入足量的NaOH溶液
C.将该物质与足量的NaOH溶液共热,再通入足量CO2气体
D.将该物质与稀硫酸共热后,再加入足量的Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】将200mL CuSO4和Fe2(SO4)3的混合溶液分成两等份,向其中一份加入足量铁粉,充分反应后测得固体质量保持不变;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到23.3g白色沉淀。请计算:
(1)原溶液中c(SO42-) = __________。
(2)原溶液中CuSO4和Fe2(SO4)3的物质的量比为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com