
科目: 来源: 题型:
【题目】有机制药工业中常用以下方法合成一种药物中间体(G):
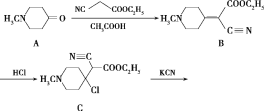
(1)G的分子式是___。
(2)化合物A中含氧官能团的名称为___。
(3)由C→D的反应类型为___;化合物E的结构简式为___。
(4)写出B→C的反应的化学方程式:___。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:___。
①能与新制Cu(OH)2在加热条件下反应生成砖红色沉淀,水解产物之一能与FeCl3溶液发生显色反应;
②核磁共振氢谱为四组峰,峰面积比为1∶2∶4∶9;
③分子中含有氨基。
(6)已知:RCN![]() RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备
RCH2NH2,请写出以HOOCCH2CH2COOH和CH3CH2Cl为原料制备![]() 的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图___(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH![]() CH2
CH2![]() CH2
CH2![]() CH3CH2Cl
CH3CH2Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

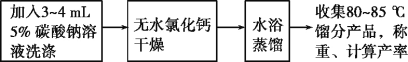
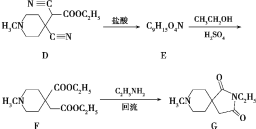
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fe、Cu、Cr都是第四周期过渡元素,回答下列问题。
(1)FeCl3是一种常用的净水剂,Cl元素的原子核外有___种不同运动状态的电子;有___种不同能级的电子,基态Fe3+的电子排布式为___。
(2)实验室中可用KSCN或K4[Fe(CN)6]来检验Fe3+。FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;K4[Fe(CN)6]与Fe3+反应可得到一种蓝色沉淀KFe[Fe(CN)6],该物质晶胞的![]() 结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
结构如图所示(K+未画出),则一个晶胞中的K+个数为___。
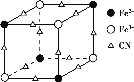
(3)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有___(填字母)。
,该配离子中含有的化学键类型有___(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有___个σ键,C原子的杂化方式为___。
(4)金属铜的晶胞为面心立方最密堆积,边长为361pm。则铜原子的直径约为___pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据如图所示示意图,下列说法不正确的是( )
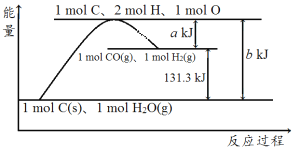
A.反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B.该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C.amol C和amol H2O(l)反应生成amol CO和a mol H2吸收的热量一定为131.3a kJ
D.1mol C、2mol H、1mol O转变成1mol CO(g)和1mol H2(g)放出的热量为a kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)t1℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为___。
②5~6min时间段内,平衡移动方向为___(填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是___(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度
c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度___c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图1所示:

①用CO还原FeO制备Fe的反应是___(填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2___T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图2所示。
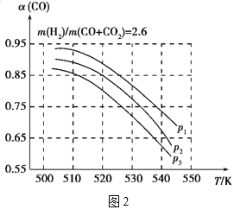
图中的压强由大到小的顺序为___,判断理由是___;试解释CO平衡转化率随温度升高而减小的原因是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4![]() Ba2++SO42-
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
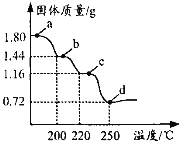
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以铅铁矿(主要成分为FeOCr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠 (Na2Cr2O72H2O),其主要反应为:
①4FeO Cr2O3 + 8Na2CO3 + 7O2 ![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4 + H2SO4 ![]() Na2SO4 + Na2Cr2O7 + H2O
Na2SO4 + Na2Cr2O7 + H2O
下列说法中正确的是
A.反应①和②均为氧化还原反应
B.反应①中FeO Cr2O3是还原剂,在反应中失去电子。
C.反应②中Na2CrO4发生氧化反应
D.生成l mol的CO2,反应①转移3.5 mol电子
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com