
科目: 来源: 题型:
【题目】依据事实,回答下列问题。
(1)在25℃、101kPa时,1.0gC8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为___kJ/mol。
(2)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式____。
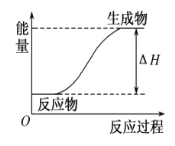
(3)某反应过程中的能量变化如图所示,则该反应是____(填“放热”或“吸热”)反应,判断依据是____。
(4)已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462kJmol-1
![]() ,
,![]()
则断开1molH–N键与断开1molH–Cl键所需能量相差约为_____kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0molL-1的Na2CrO4溶液的pH(忽略溶液体积变化),测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线。下列说法不正确的是( )
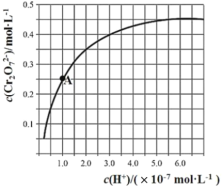
A.平衡时,pH越小,c(Cr2O72-)越大
B.A点CrO42-的平衡转化率为50%
C.A点CrO42-转化为Cr2O72-反应的平衡常数K=1014
D.平衡时,若溶液中c(Cr2O72-)=c(CrO42-),则c(H+)>2.0×10-7mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应△>0)某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下。

(1)吸硫装置如图所示。

①装置B的作用是检验装置中SO2的吸收效率,B中试剂是________,表明SO2吸收效率低的实验现象是B中溶液________________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是_______、_______。(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验。(室温时CaCO3饱和溶液的pH=12), 限用试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管、
序号 | 实验操作 | 预期现象 | 结论 |
① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成 | 样品含NaCl |
② | 另取少量样品于烧杯中,加入适量蒸馏水,充分振荡溶解,_________。 | 有白色沉淀生成,上层清液pH>10.2 | 样品含NaOH |
(3)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:
第一步:准确称取ag KIO3(相对分子质量:214)固体配成溶液,
第二步:加入过量KI固体和H2SO4溶液,滴加指示剂,
第三步:用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液溶液的体积为vmL 则c(Na2S2O3溶液)=_______mol·L-1。(只列出算式,不作运算)
已知:IO3-+I-+6H+=3I2+3H2O ,2S2O32-+I2=S4O62-+2I- 某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3的浓度可能_____(填“不受影响”、“偏低”或“偏高”) ,原因是________(用离子方程式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
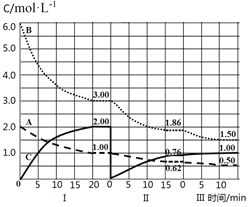
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
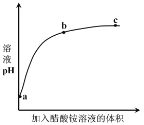
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F均为短周期主族元素,且它们的原子序数依次增大,B和E同主族,A、B在元素周期表中处于相邻的位置,C元素原子在同周期主族元素原子中半径最大,D是地壳中含量最多的金属元素,E元素原子的最外层电子数是电子层数的2倍。请回答下列问题。
(1)画出F的原子结构示意图:__。
(2)B、C、E的简单离子的半径由大到小的顺序为__(用离子符号表)。
(3)在加热条件下,B的常见单质与C的单质发生反应,将所得产物溶于水时所发生反应的化学方程式为__。
(4)D的单质能与C的最高价氧化物对应水化物的溶液反应生成无色气体,该反应中的氧化剂为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E、F六种主族元素,已知:(a)A原子有四个电子层,其K、L层电子数分别与N、M层电子数相等;(b)B、C原子核外电子层数比A原子少1,B的最高正价和最低负价的代数和等于零,C的简单气态氢化物的化学式是H2C;(c)D、E的阴离子都带有一个单位的负电荷,D的阴离子的电子层结构与氩原子相同,E元素没有对应的含氧酸;(d)F与A位于同一周期且是六种元素中原子半径最大的元素。
(1)写出六种元素的名称:A___;B___;C___;D___;E___;F___。
(2)A、C、D、F四种元素的简单离子的半径由大到小的顺序为____(用离子符号表示)。
(3)B、C、D三种元素的简单气态氢化物的稳定性由强到弱的顺序为___(用化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,在一容积可变的密闭容器里,反应 2A(g)B(g)+2C(g)达到平衡时,A、B 和 C 的物质的量分别为 4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入 1mol 稀有气体氦(He),平衡将不发生移动
B.充入A、B、C 各 1mol,平衡将向正反应方向移动
C.将 A、B、C 各物质的物质的量都减半,C 的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各物质中,除氢原子外,每个原子最外层均达到8电子结构,则它们的结构式错误的是( )
A.氧分子:O=O
B.S2Cl2:Cl-S-S-Cl
C.氢氰酸:H-C![]() N
N
D.光气(COCl2):Cl-C-O-Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com