
科目: 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Z、Q、R、T、U分别代表原子序数依次增大的短周期元素,在周期表的短周期主族元素中,X的原子半径最小,X与R的最外层电子数相等;Z的内层电子数是最外层电子数的一半;U的最高化合价和最低化合价的代数和为6;R和Q可形成原子个数之比为1:1和2:1的两种化合物;T与Z同主族。请回答下列问题:
(1)T元素在周期表中的位置是________________________。
(2)X、Z、Q三种元素的原子半径由小到大的顺序为___________(填元素符号)。
(3)R、T两元素最高价氧化物对应的水化物反应的化学方程式为____________。
(4)某同学用X、R两元素的单质反应生成固体物质RX,RX属于离子化合物,且能与化合物X2Q反应生成X的单质。
①RX的电子式为_____________;RX与X2Q反应的化学方程式为___________。
②该同学认为取X、R两元素的单质反应后的固体物质与X2Q反应,若能产生![]() 的单质,即可证明得到的固体物质一定是纯净的RX。请判断该方法是否合理并说明理由:_____________。
的单质,即可证明得到的固体物质一定是纯净的RX。请判断该方法是否合理并说明理由:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活生产密切相关。下列说法中错误的是
A.施肥时,铵态氮肥不能与草木灰(含K2CO3)混合使用
B.钡中毒患者可尽快使用苏打溶液洗胃,将Ba2+转化为BaCO3而排出
C.夏天冰箱保鲜食品的原理是降低温度,减慢化学反应速率
D.纯碱溶液显碱性,加热去油污效果更佳。
查看答案和解析>>
科目: 来源: 题型:
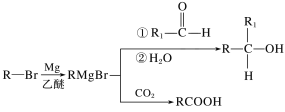
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
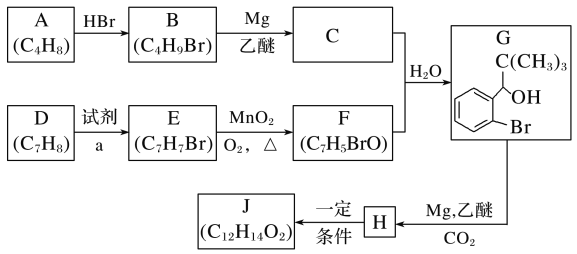
已知:
(1)B的化学名称是__,F中官能团名称是__。
(2)由E生成F的反应类型是__,由H生成J的反应类型是__。
(3)试剂a是__。
(4)J是一种环酯,则J的结构简式为__。H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为__。
(5)利用题中信息写出以乙醛和苯为原料,合成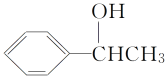 的流程图(其他试剂自选)___。
的流程图(其他试剂自选)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像正确的是( )
A.向CaIOH)2和NaOH的混合溶液中通入CO2 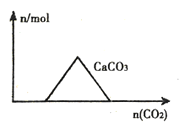
B.向1L浓度均为0.1mol/L的NaAlO2、Ba(OH)2的混合溶液中加入0.1mol/L的稀H2SO4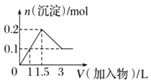
C.向1L浓度分别为0.1mol/L和0.3mol/L的AlCl3、NH4Cl的混合溶液中加入0.1mol/L的稀NaOH溶液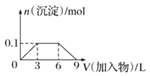
D.向氢氧化钠溶液中滴加明矾溶液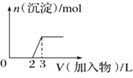
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为__,该能层上具有的原子轨道数为__,电子数为__。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?__(填“是”或“否”)。
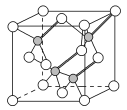
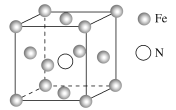
(3)镓与第ⅤA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图所示(白色球代表As原子)。在GaAs晶体中,每个Ga原子与__个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为__。
(4)与As同主族的短周期元素是N、P。AsH3中心原子杂化的类型__;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是__,理由是__。
(5)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为__;设晶胞边长为acm,阿伏加德罗常数的值为NA,该晶体的密度为__g·cm-3(用含a和NA的式子表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是 ( )
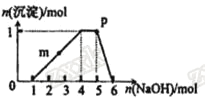
A.m点处反应:H++OH-=H2O
B.p点:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的有机化工原料,目前世界甲醇年产量超过2.1×107吨,在能源紧张的今天,甲醇的需求也在增大。甲醇的合成方法是:
(ⅰ)CO(g)+2H2(g)=CH3OH(g) ΔH=-90.1kJ·mol-1
另外:(ⅱ)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ·mol-1
(ⅲ)2H2(g)+O2(g)=2H2O(l) ΔH=-572.0kJ·mol-1
回答下列问题:
(1)甲醇的燃烧热为__kJ·mol-1。
(2)在碱性条件下利用一氯甲烷(CH3Cl)水解也可制备少量的甲醇,该反应的化学方程式为__。
(3)若反应在密闭恒容绝热容器中进行,反应(iv)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=+41.1kJ·mol-1对合成甲醇反应中CO的转化率的影响是(_________)
a.增大 b.减小 c.无影响 d.无法判断
(4)在恒温恒容的密闭容器中发生反应(ⅰ),各物质的浓度如下表:
浓度/mol·L-1 时间/min | c(CO) | c(H2) | c(CH3OH) |
0 | 0.8 | 1.6 | 0 |
2 | 0.6 | x | 0.2 |
4 | 0.3 | 0.6 | 0.5 |
6 | 0.3 | 0.6 | 0.5 |
①x=__。
②前2min内H2的平均反应速率为v(H2)=__。该温度下,反应(ⅰ)的平衡常数K=__。(保留1位小数)
③反应进行到第2min时,改变了反应条件,改变的这个条件可能是(_________)
a.使用催化剂 b.降低温度 c.增加H2的浓度
(5)如图是温度、压强与反应(ⅰ)中CO转化率的关系:
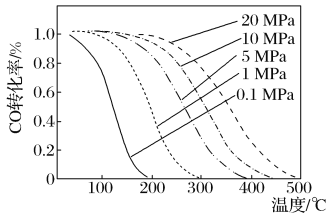
由图像可知,温度越低,压强越大,CO转化率越高,但实际生产往往采用300~400℃和10MPa的条件,其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
Ⅰ.探究1:验证同周期X、Y、Z三种元素金属性递变规律
实验内容 | 实验现象 |
1、各取1.0g金属X和金属Z,分别加入到5mL水中 | 金属X与水反应比金属Z剧烈 |
2、各取1.0g的金属Z和金属Y(形状相同),分别加入到5mL1.0mol/L盐酸中。 | 金属Z与盐酸反应比金属Y剧烈 |
通过实验验证三种元素金属性由强到弱是_____,则下列判断正确的是(__________)
A.原子序数:Y>Z>X B.原子的最外层电子数X>Y>Z
C.原子半径:Y>Z>X D.Y的最高价氧化物对应水化物的碱性最强
Ⅱ.探究2:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
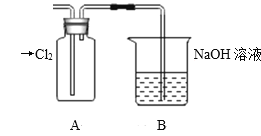
(1)装置A中盛放的试剂是_______(填选项),化学反应方程式是_________。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
A.HCl比H2S稳定
B.HClO氧化性比H2SO4强
C.HClO4酸性比H2SO4强
D.铁与Cl2反应生成FeCl3,而硫与铁反应生成FeS
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用原子结构理论解释非金属性Cl>I的原因:同主族元素从上到下,________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com