
科目: 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 均为短周期元素,它们在周期表中的相对位置如图所示。下列说法正确的是
均为短周期元素,它们在周期表中的相对位置如图所示。下列说法正确的是
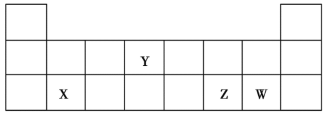
A.原子半径:![]()
B.简单氢化物的稳定性:![]()
C.元素![]() 与元素
与元素![]() 可形成化合物
可形成化合物![]() ,且
,且![]() 是共价化合物
是共价化合物
D.由简单氢化物水溶液的酸性:![]() ,可推知元素的非金属性:
,可推知元素的非金属性:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素![]() 、
、![]() 、
、![]() 、
、![]() 的原子序数依次增大,
的原子序数依次增大,![]() 的原子在元素周期表中半径最小;
的原子在元素周期表中半径最小;![]() 的次外层电子数是其最外层电子数的
的次外层电子数是其最外层电子数的![]() ;
;![]() 的单质可与冷水剧烈反应,产生
的单质可与冷水剧烈反应,产生![]() 的单质;
的单质;![]() 与
与![]() 属于同一主族。下列叙述正确的是
属于同一主族。下列叙述正确的是
A.![]() 元素形成的简单离子与
元素形成的简单离子与![]() 元素形成的简单离子的核外电子总数相同
元素形成的简单离子的核外电子总数相同
B.单质的氧化性:![]()
C.化合物![]() 、
、![]() 、
、![]() 中化学键的类型完全相同
中化学键的类型完全相同
D.原子半径:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】我国国家标准(GB2760)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
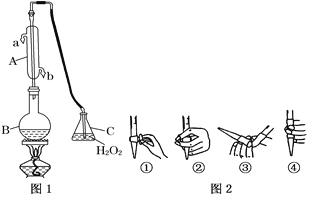
(1)仪器A的名称是__________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为_____________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的______;若滴定终点时溶液的pH=8.8,则选择的指示剂为______;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)__________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: ____________。
(6)常温下,用一定量的NaOH溶液吸收逸出的SO2气体,若吸收后的吸收液恰好呈中性,下列关于该吸收液的说法正确的是______________________。
A.c(Na+)=c(HSO3-)+2c(SO32-) |
B.c(Na+)>c(HSO3-)=c(SO32-)>c(H+) = c(OH-) |
C.2c(Na+)=3c(H2SO3)+3c(HSO3-)+3c(SO32-) |
D.c(Na+)>c(HSO3- ) + c(SO32-) +c(H2SO3) |
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化铝(A1N)是一种新型无机非金属材料。某A1N样品仅含有Al2O3杂质,为测定A1N的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
(方案一)
取一定量的样品,用以下装置测定样品中A1N的纯度(夹持装置已略去)。
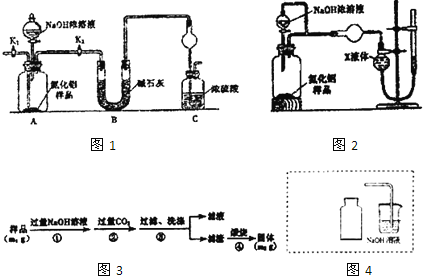
(1)如图1C装置中球形干燥管的作用是___。
(2)完成以下实验步骤:组装好实验装置,首先___再加入实验药品。接下来的实验操作是___,打开分液漏斗活塞,加入浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化,通入氮气的目的是___。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见____。
(方案二)
用如图2装置测定mg样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是___。
a.CCl4 b.H2O c.NH4Cl溶液 d.苯
(5)若mg样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数____。
(方案三)
按如图3步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为____。
(7)若在步骤③中未洗涤,测定结果将___(填“偏高”“偏低’或“无影响”)。
(8)实验室制取NO2气体。在如图4虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图___(夹持仪器略)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Y 是一种天然除草剂,其结构如图所示,下列说法正确的是( )
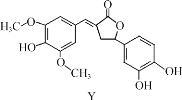
A.Y 可以和NaHCO3 溶液发生反应
B.Y 分子中所有碳原子一定在同一平面内
C.1 mol Y 最多能与 6 mol NaOH 反应
D.Y 与足量的H2加成反应的产物含 7 个手性碳原子
查看答案和解析>>
科目: 来源: 题型:
【题目】下表为几种短周期元素的性质:
元素编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径 | 66 | 160 | 152 | 110 | 99 | 186 | 70 | 88 |
最高化合价 |
|
|
|
|
|
|
| |
最低化合价 |
|
|
|
|
下列有关上述元素的说法正确的是
A.元素⑤的氢化物的沸点高于元素①的氢化物的沸点
B.②⑦形成的化合物为共价化合物
C.上述八种元素中,最高价氧化物对应水化物的酸性最强的是元素⑤
D.元素⑧位于周期表中第3周期ⅢA族
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO。某小组在实验室制备NaClO溶液,并进行性质探究和成分测定。
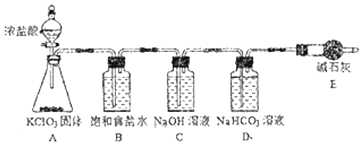
(1)该小组按如图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表。(已知饱和NaClO溶液pH为11)
实验步骤 | 实验现象 | ||
B瓶 | C瓶 | D瓶 | |
实验1:取样,滴加紫色石蕊溶液 | 变红,缓慢褪色 | 变红,缓慢褪色 | 立即褪色 |
实验2:取样,测定溶液的pH | 3 | 12 | 7 |
①装置A中反应的化学方程式为____。
②B瓶溶液中H+的主要来源是____。
③C瓶溶液的溶质是___(填化学式)。
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因____。
(2)测定C瓶溶液中NaClO含量(单位:gL-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应。
Ⅱ.用0.1000molL-1Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mLNa2S2O3溶液。(I2+2S2O32-=2I-+S4O62-)
①NaClO的电子式为____。
②步骤Ⅰ总反应的离子方程式为____。
③C瓶溶液中NaClO的含量为____gL-1。(保留1位小数,NaClO式量为74.5)
查看答案和解析>>
科目: 来源: 题型:
【题目】分子式为C8H14O4的有机物在酸性条件下水解生成一种酸和一种醇,且酸和醇的物质的量之比为1:2,则符合该条件的有机物有( )(不考虑立体异构)
A.8种B.10种C.13种D.16种
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:乙炔的结构为H—C≡C—H,4个原子在同一直线上,能与单质溴发生加成反应,1,4-二苯基丁二炔广泛应用于农药的合成,其结构如图所示。下列有关该物质的说法不正确的是( )
![]()
A.该有机物的化学式为C16H10
B.该分子中处于同一直线上的原子最多有6个
C.该物质能使溴的四氯化碳溶液褪色
D.该分子中所有原子可能位于同一平面上
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S = Na2S2O3 。常温下溶液中析出晶体为Na2S2O35H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如下左图所示。
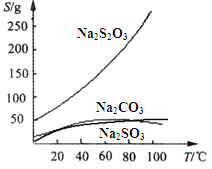
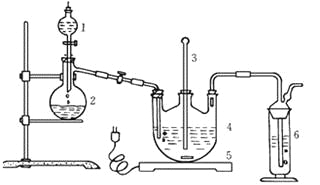
Ⅰ.现按如下方法制备Na2S2O3·5H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓盐酸,在装置2中加入亚硫酸钠固体,并按上右图安装好装置。
(1)仪器2的名称为______________,装置6中可放入___________。
A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
① Na2CO3+SO2=Na2SO3+CO2②Na2S+SO2+H2O=Na2SO3+H2S
③ 2H2S+SO2=3S↓+2H2O ④ Na2SO3+S![]() Na2S2O3
Na2S2O3
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:_____________(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O3·5H2O并测定含量:
![]()
(3)为减少产品的损失,操作①为__________,操作②是过滤洗涤干燥,其中洗涤操作是用________(填试剂)作洗涤剂。
(4)蒸发浓缩滤液直至溶液呈微黄色浑浊为止,蒸发时为什么要控制温度不宜过高_____________。
(5)制得的粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)
试回答:
①KMnO4溶液置于__________(填“酸式”或“碱式”)滴定管中。
②滴定终点时的颜色变化:_____________________。
③产品中Na2S2O3·5H2O的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com