
科目: 来源: 题型:
【题目】等体积、浓度均为0.2mol·L-1的三种溶液:①HA溶液、②HB溶液、③NaHCO3溶液,已知将①②分别与③混合,实验测得所产生的CO2气体体积(V)随时间(t)的变化如图所示。下列说法不正确的是
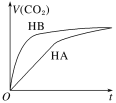
A. 酸性:HB>HA>H2CO3
B. 恰好反应时,所得两溶液中:c(A-)>c(B-)
C. 上述三种溶液中由水电离出的c(OH-)的相对大小:③>①>②
D. HA溶液和NaHCO3溶液恰好反应,所得的溶液中:c(A-)+c(HA)=0.1mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。
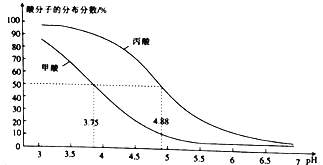
下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目: 来源: 题型:
【题目】很多含氯化合物都是重要的漂白剂
Ⅰ、亚氯酸钠(NaClO2)是一种常见漂白剂,某探究小组开展如下实验,回答下列问题:
制取NaClO2晶体按如下图装置进行制取。
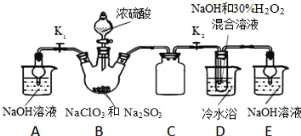
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是______;检验该离子的方法是____________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________。
Ⅱ、ClO2也是一种常见漂白剂,用ClO2处理过的饮用水常含有一定量有害的ClO![]() 。我国规定饮用水中ClO
。我国规定饮用水中ClO![]() 的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO
的含量应不超过0.20 mg·L-1。测定水样中ClO2、ClO![]() 的含量的过程如下:
的含量的过程如下:
①量取25.00 mL水样加入到锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-===2ClO![]() +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45 mL。此过程发生反应:2S2O![]() +I2===S4O
+I2===S4O![]() +2I-。
+2I-。
④调节第③步所得溶液至pH≤2.0,此过程发生反应ClO![]() +4H++4I-===Cl-+2I2+2H2O。
+4H++4I-===Cl-+2I2+2H2O。
⑤再向溶液中滴加1.00×10-3 mol·L-1 Na2S2O3溶液至蓝色刚好褪去,消耗Na2S2O3溶液30.00 mL
根据上述数据计算并判断该水样中ClO![]() 的含量是否符合国家规定。
的含量是否符合国家规定。
______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室以锈蚀程度很大的废铁屑为原料制备FeCl3·6H2O晶体的流程可简要表示如下:
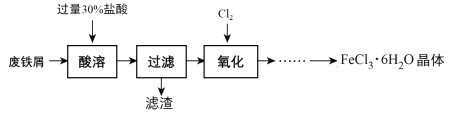
已知:在水溶液中Fe2+能与K3Fe(CN)6生成蓝色沉淀Fe3[Fe(CN)6]2。
试回答下列问题:
(1) “酸溶”过程中发生主要反应有:
①Fe + 2H+= Fe2++ H2↑;②Fe2O3+ 6 H+= 2Fe3++ 3H2O;③__________________。(用离子方程式)
(2) “酸溶”需控制温度在40℃左右,最佳的加热方式是____________。
(3) “氧化”过程可在下图所示装置中进行。
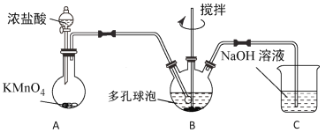
①装置A中KMnO4与浓盐酸反应生成MnCl2和Cl2,其离子方程式为______________________。
②装置C的作用是__________________________________________________。
③为使Cl2能充分发生反应,除在B中使用多孔球泡和搅拌外,实验中可采取的措施是_____________________________________________________________________。
④证明装置B溶液中Fe2+已完全________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A. WZ的水溶液呈碱性
B. 元素非金属性的顺序为X>Y>Z
C. Y的最高价氧化物的水化物是中强酸
D. 该新化合物中Y不满足8电子稳定结构
查看答案和解析>>
科目: 来源: 题型:
【题目】钴铁氧体(CoFe2O4)不仅是重要的磁性材料、磁致伸缩材料,还是重要的锂离子电池负极材料。工业上,可以由废旧锂钴电池正极材料(主要含Fe、Al、硅等杂质)回收钴,再用电化学法制得CoFe2O4。其流程如图所示(过程中所加试剂均足量)
Ⅰ.废旧电池中钴的回收
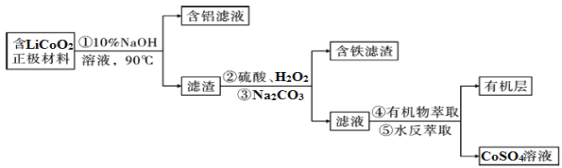
(1)写出过程②中LiCoO2与H2O2发生反应的化学方程式:__________________________。
(2)过程③Na2CO3的主要作用为__________________。
Ⅱ.电解法制得钴铁合金
(3)配制0.050molL1FeSO4和0.025molL1CoSO4的混合溶液,用铜作阴极、石墨作阳极进行电解,获得CoFe2合金。阴极的电极方程式为:___________。
Ⅲ.阳极氧化法制得钴铁氧体
(4)以1.500molL1NaOH溶液作电解液,纯净的钴铁合金(CoFe2)作阳极进行电解,在阳极上获得CoFe2O4薄膜。该电解过程的化学方程式为__________________________。
(5)当电路上有0.4mol电子转移时,阳极电极材料增重质量为3.4g,与理论值不符,其原因可能为_______________。
(6)由废旧锂钴电池制CoFe2O4的现实意义在于:_____(写一条即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A. 钢铁在潮湿的空气中容易生锈
B. 棕红色NO2加压后颜色先变深后变浅
C. 高温及加入催化剂都能使合成氨的反应速率加快
D. H2、I2、HI平衡混合气加压后颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL废液加入足量的AgNO3溶液,生成沉淀 8.61g。(2)另取10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断不正确的是( )
A.一定含有Fe 2+、Fe 3+、Cu2+、ClˉB.c(Clˉ) = 6mol / L,c(Fe 2+) = 0.6mol /L
C.c(Fe2+)︰c(Fe3+) = 3︰1D.c(Fe2+)︰c(Cu2+) = 2︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com