
科目: 来源: 题型:
【题目】将12.8g两种金属的混合物投入足量的盐酸中,反应完全后得到氢气11.2L(标准状况),该混合物的组成可能是( )
A.钙和锌B.镁和铜C.铝和镁D.钠和铁
查看答案和解析>>
科目: 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题:
(1)写出Fe的基态原子的电子排布式_________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为____________________,它们的氢化物沸点最高的是____________。其原因是__________,将NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,则该阴离子的化学式是_____________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为______________。
②[Co(N3)(NH3)5]SO4中Co的配位数为____________,其配离子中含有的化学键类型为_______(填离子键、共价键、配位键),C、N、O 的第一电离能最大的为_______,其原因是_____________________。
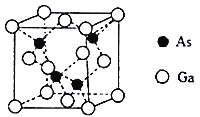
(4)砷化镓晶胞结构如图。晶胞中Ga与周围等距且最近的As形成的空间构型为________。已知砷化镓晶胞边长为apm,其密度为pg·cm-3,则阿伏加德罗常数的数值为__________________(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
【题目】NO、NO2是大气污染物,但只要合理利用也是重要的资源。
(1)NH3还原法可将NO2还原为N2进行脱除。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H1=-1530 kJ·mol-1
②N2(g)+O2(g)=2NO(g) △H2=+180 kJ·mol-1
写出NH3还原NO的热化学方程式:_________________________________________。
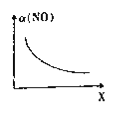
(2)亚硝酰氯(ClNO)是合成有机物的中间体。将一定量的NO与Cl2充入一密闭容器中,发生反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
2ClNO(g) △H<0。平衡后,改变外界条件X,实验测得NO的转化率a(NO)随X的变化如图所示,则条件X可能是________(填字母)。
a.温度 b.压强 c.![]() d.与催化剂的接触面积
d.与催化剂的接触面积
(3)在密闭容器中充入4 mol CO和5 mol NO,发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
N2(g)+2CO2(g) △H1=-746.5 kJ·mol-1,图为平衡时NO的体积分数与温度、压强的关系曲线图。
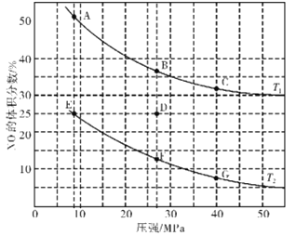
①温度:T1_______(填“<”或“>”)T2。
②若反应在D点达到平衡,此时对反应进行升温且同时扩大容器体积使平衡压强减小,重新达到平衡,则D点应向图中A~G点中的_______点移动。
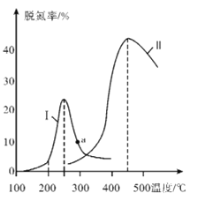
③某研究小组探究催化剂对CO、NO转化的影响。将NO和CO以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中NO含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。温度低于200℃时,图中曲线I脱氮率随温度升高而变化不大的主要原因为____________;a点_______(填“是”或“不是”)对应温度下的平衡脱氮率,说明其理由:___________________________________。
(4)以连二硫酸根(S2O42-)为媒介,使用间接电化学法处理燃煤烟气中的NO,装置如图4所示:

①阴极区的电极反应式为______________________________________。
②NO被吸收转化后的主要产物为NH4+,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上被吸收的NO在标准状况下的体积为____________mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中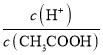 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.2mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
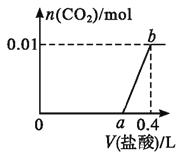
A.在0~a范围内,只发生反应OH-+H+=H2O
B.a=0.35
C.ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
D.原混合溶液中NaOH与Na2CO3的物质的量之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】列关于氯气的实验装置能达到实验目的的是
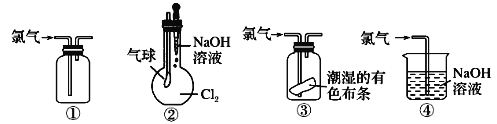
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收
A. ①② B. ①③ C. ②③ D. ①④
查看答案和解析>>
科目: 来源: 题型:
【题目】向0.10 mol·L-1的Na2CO3溶液中逐滴加入稀盐酸,加入的HCl与原溶液中Na2CO3的物质的量之比f[f=![]() ]与混合液pH的关系如图所示。下列说法正确的是( )
]与混合液pH的关系如图所示。下列说法正确的是( )

A.f=0时,溶液中:c(Na+)=2c(![]() )
)
B.f=0.5时,溶液中:c(![]() )>c(
)>c(![]() )
)
C.f=1时,溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.f=2时,溶液中:![]() c(Na+)=c(
c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目: 来源: 题型:
【题目】一个电化学过程的示意图如图所示。

请回答下列问题:
(l)通入CH3CH2OH一极的电极反应式为__________________________。
(2)乙池是铜的精炼池,则A电极的材料是_____________;反应一段时间后,乙池溶液中c(Cu2+)__________(填“增大”“变小”或“不变”)。
(3)丙池含有0.01 mol KCl的溶液100mL,假如电路中转移了0.03 mol e-,则阳极产生的气体在标准状况下的体积是________。
(4)丙池中滴有酚酞,实验开始后观察到的现象是_______________________________,写出丙池的总反应方程式:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com