
科目: 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如图转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
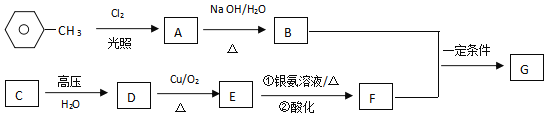
(1)G的结构简式为______。
(2)C转化为D的反应类型:______。
(3)写出B和F反应生成G的化学方程式:______。
(4)写出同时符合下列条件的G的同分异构体结构简式______、______。
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜;
③核磁共振氢谱共有4种吸收峰。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法错误的是( )

A.气态氢化物稳定性:R>Q
B.元素T的离子半径>元素R的离子半径
C.与W同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键
D.Q可形成多种同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
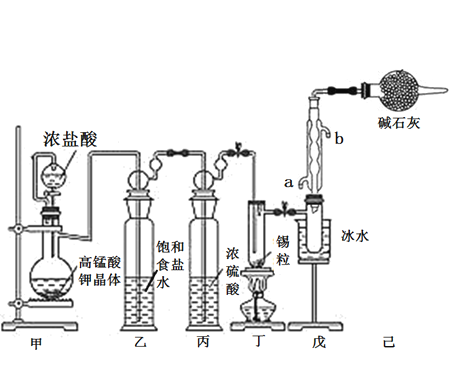
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计以下实验。
Ⅰ.将![]() 溶液与
溶液与![]() 溶液混合生成
溶液混合生成![]() ,从而验证
,从而验证![]() 的碱性强于
的碱性强于![]() ,继而可以验证
,继而可以验证![]() 的金属性强于
的金属性强于![]() 。此设计 ______(填“合理”或“不合理”),理由是______。
。此设计 ______(填“合理”或“不合理”),理由是______。
Ⅱ.利用如图所示装置可以验证非金属性的变化规律。
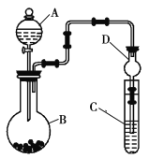
(1)仪器A的名称为______,干燥管D的作用是______。
(2)实验室中现有药品:![]() 溶液、
溶液、![]() 、浓盐酸、
、浓盐酸、![]() ,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
,请选择合适的药品设计实验来验证氯的非金属性强于硫。装置A、B、C中所装药品分别为______、______、______,装置C中的实验现象为有黄色沉淀生成,相关反应的离子方程式为______。
(3)若要证明非金属性:![]() ,则A中加______,B中加
,则A中加______,B中加![]() ,C中加______,观察到C中的现象为______。
,C中加______,观察到C中的现象为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
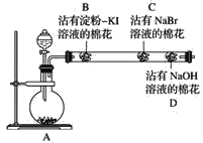
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
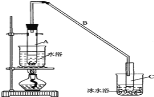
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: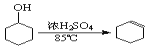 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
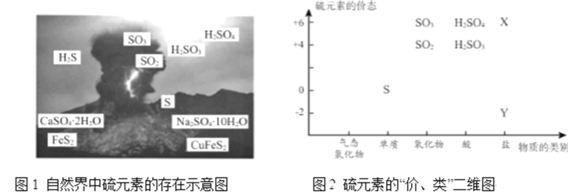
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
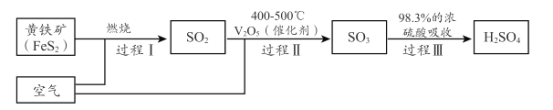
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2 和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2 和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
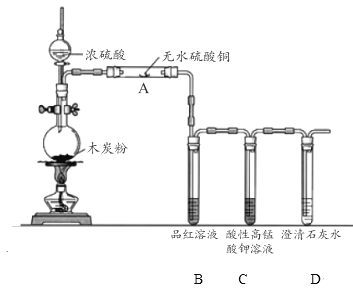
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把河沙(主要成分是![]() )与镁粉按一定质量比(质量比略大于
)与镁粉按一定质量比(质量比略大于![]() )混合均匀,装入试管中加热大约
)混合均匀,装入试管中加热大约![]() 后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下发生反应的化学方程式:______。
(2)生成的混合物放入稀硫酸中,产生的气体是______(填分子式)。
(3)用化学方程式表示产生“爆炸声”的原因:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
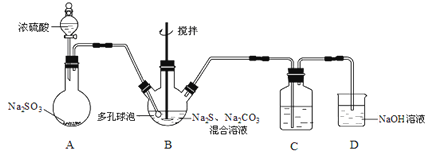
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com