
科目: 来源: 题型:
【题目】某二元醇的结构简式![]() ,关于该有机物的说法错误的是( )
,关于该有机物的说法错误的是( )
A.用系统命名法命名:5-甲基-2,5-庚二醇
B.该有机物通过消去反应能得到 6 种不同结构的二烯烃(不考虑立体异构)
C.该有机物通过催化氧化后产物只有一种官能团
D.1mol 该有机物能与足量金属 Na 反应产生 H2 22.4L(标况)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上从海水中提溴,实验室中从海带中提碘的过程中发生反应的离子方程式有:
![]()
![]()
![]()
回答下列问题:
(1)根据所给出的反应,判断![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性强弱,可以明确得出的结论是____、___。
的氧化性强弱,可以明确得出的结论是____、___。
(2)将适量溴水加入氟化钠溶液中,__(填“能”或“不能”)观察到明显现象。
(3)将适量碘水加入氯化钠溶液中,__(填“能”或“不能”)观察到明显现象。
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较卤素单质的氧化性进行以下实验:①将新制氯水滴入溴化钠溶液中,溶液变黄色;②将新制氯水滴入碘化钾溶液中,溶液变褐色。下列有关说法不合理的是( )
A.①中发生的离子反应为![]()
B.向②所得溶液中再加入![]() 振荡,静默,下层溶液呈紫红色
振荡,静默,下层溶液呈紫红色
C.将①、②可得出结论:氧化性![]()
D.将②中新制氯水换成溴水,若实验现象相同,即可得出氧化性![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
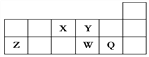
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.苯甲酸共有4种同分异构体(含苯环且包括苯甲酸)
B.相同条件下的沸点:乙二醇>乙醇>乙烷>甲烷
C.CH3COOCH3在核磁共振氢谱中有2种不同类型的氢原子
D.两种不同的氨基酸在缩聚反应时可生成不少于4种的聚合物
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下表回答问题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中______(填元素符号)的非金属性最强;______(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:______。
(2)表中元素③的原子结构示意图是______。
(3)表中元素⑤、⑦的氢化物的稳定性顺序为______>______(填化学式)。
(4)表中元素最高价氧化对应水化物中酸性最强的是______(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列由电子排布式或排布图所得的结论错误的是( )
选项 | 电子排布式 | 结论 |
A | 1s22s22p | 违背洪特规则 |
B | 1s22s22p63s23p63d3 | 违背能量最低原理 |
C | N的电子排布图: | 违背泡利原理 |
D | 1s22s22p63s23p63d54s1 | 违背能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物F用于制造香精,可利用下列路线合成。回答下列问题:
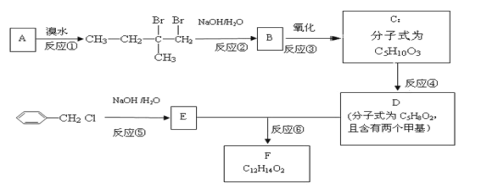
(1)A的化学名称是___。
(2)B的结构简式是___。
(3)①~⑥中属于取代反应的有___(填序号)。
(4)反应⑥的化学方程式为___。
(5)C有多种同分异构体,与C具有相同官能团的有__种(不包括C),其中核磁共振氢谱为四组峰的结构简式为___(任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
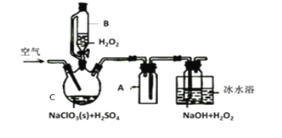
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com