
科目: 来源: 题型:
【题目】电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。回答下列问题:
(1)已知:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=-45.8kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH2=-1277.0kJ·mol-1
则2CO2(g)+2H2O(g)=C2H4(g)+3O2(g)ΔH3=____。
(2)电化学法还原二氧化碳为乙烯原理如图所示。
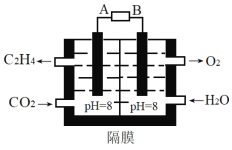
A为电源的___极(填“正”或“负”),阴极电极反应式为___。电路中转移0.2mol电子,理论上产生氧气___L(标准状况)。
(3)铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是___(填标号)。
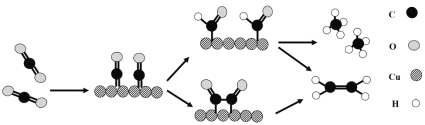
A.铜是二氧化碳转化为乙烯的催化剂
B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( )
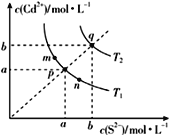
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向n点的溶液中加入少量CdCl2固体,溶液组成由n沿npm线向m方向移动
D.温度升高时,p点的饱和溶液的组成由p沿pq线向q方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)图1为用电解法制备H2,写出阳极的电极反应式:____________________________。
(2)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是________。
A.将研究方向专注于紫外光区,无需考虑可见光区
B.研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=-206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:__________________________________。
(4)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图2所示:
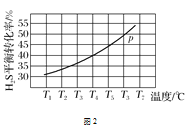
①温度为T4 ℃时,初始体积为1 L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
②若保持恒温T ℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图3上画出不同起始压强下H2S转化率的趋势图。 _________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、CO32-、SO42-、NO3-中的若干种离子,离子浓度均为0.1mol/L,某同学进行如下实验。下列说法正确的是

A. 无法确定沉淀C 的成分
B. 无法确定原试液中是否存在K+、Al3+、Cl-、
C. 试液中可能含有CO32-、K+、NH4+
D. 试液中一定存在的离子为NH4+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目: 来源: 题型:
【题目】一定质量的镁、铝合金与硝酸恰好完全反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,将这些气体与标准状况下3.36 L O2混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸盐溶液中加入2 mol/L NaOH溶液至沉淀最多时停止加入,将沉淀滤出,向滤液中加水稀释至500 mL,此时所得溶液的物质的量浓度为( )
A. 0.5 mol/LB. 1 mol/L
C. 1.2 mol/LD. 2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关反应限度的叙述正确的是
A. 使用催化剂,可降低反应的活化能,加快反应速率,改变反应限度
B. 依据焓判据:NH4HCO3受热分解可自发进行
C. 大多数化学反应在一定条件下都有一定的限度
D. FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深
查看答案和解析>>
科目: 来源: 题型:
【题目】“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法不正确的是( )

A.b为电池的正极
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经交换膜2移向b极
D.H2参与的电极反应为:H2-2e-+CO32-=H2O+CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。
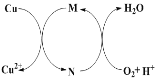
下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com