
科目: 来源: 题型:
【题目】沐舒坦(结构简式为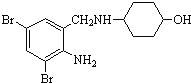 ,不考虑立体异构)在临床上使用广泛。如图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出)。
,不考虑立体异构)在临床上使用广泛。如图所示是其多条合成路线中的一条(反应试剂和反应条件均未标出)。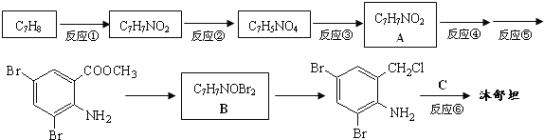
已知:![]() ,完成下列填空:
,完成下列填空:
(1)⑤的反应试剂和反应条件是___________;③的反应类型是___________。
(2)已知反应④所需的试剂是甲醇,则该反应的化学方程式是______________________________________。
(3)写出结构简式:A________________;B________________。
(4)反应⑥中除加入反应试剂C外,还需要加入K2CO3,其目的是为了中和____________;防止___________________________________。
(5)写出两种C的能发生水解反应,且只含3种不同化学环境氢原子的同分异构体的结构简式:_____________________、____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两同学为探究![]() 与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
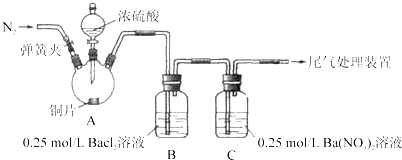
实验操作和现象:
操作 | 现象 |
关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡,B中有气泡冒出,产生大量白色沉淀,C中产生白色沉淀,液面上放略显浅棕色并逐渐消失 |
打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
从B、C中分别取少量白色沉淀,加稀盐酸 | 尚未发现白色沉淀溶解 |
(1)A中反应的化学方程式是_________________。
(2)C中白色沉淀是_______,该沉淀的生成表明SO2具有_______性。
(3)C中液面上方生成浅棕色气体的化学方程式是______。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①未证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是____;乙在A、B间增加洗气瓶D,D中盛放的试剂是______。
②进行实验,B中现象:
甲 | 大量白色沉淀 |
乙 | 少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:___。
(5)合并(4)中两同学的方案进行试验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:

(1)滤渣A经CS2提取后可获得一种淡黄色副产品,其化学式为____。
(2)浸取过程中Fe2(SO4)3的作用是________ (氧化剂或还原剂)。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为_________。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是________。
(4)置换法除重金属离子所用物质C为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
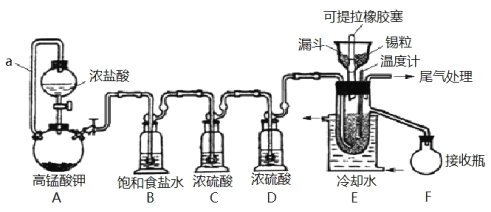
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
(5)尾气处理时,可选用的装置是___(填序号)。
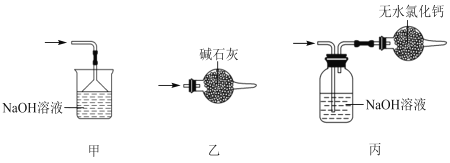
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H1=﹣154 kJmol﹣1
②S(s)+O2(g)═SO2(g)△H2=﹣297 kJmol﹣1
③2H2S(g)+O2(g)═2S(s)+2H2O(l)△H3
④2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H4
下列说法正确的是
A.△H3>△H4B.△H3=+143 kJmol﹣1
C.无法计算△H4的值D.H2S 燃烧热为 1045 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1:45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O,该反应的化学方程式为_____________。
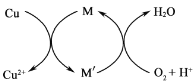
②方法2:先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。M'的化学式为______。
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。为测定某碱式氯化铜的组成,进行下列实验:
①称取样品2.2320g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25. 00mL溶液A,加入足量AgNO3溶液,得AgCl 0. 3444g;
③另取25. 00mL溶液A,调节pH 4 ~ 5,用浓度为0.08000mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液60.00mL。通过计算确定该样品的化学式(写出计算过程)。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】CH![]() 、—CH3、CH
、—CH3、CH![]() 都是重要的有机反应中间体,有关它们的说法正确的是( )
都是重要的有机反应中间体,有关它们的说法正确的是( )
A. 它们互为等电子体,碳原子均采取sp2杂化
B. CH![]() 与NH3、H3O+互为等电子体,立体构型均为正四面体形
与NH3、H3O+互为等电子体,立体构型均为正四面体形
C. CH![]() 中的碳原子采取sp2杂化,所有原子均共面
中的碳原子采取sp2杂化,所有原子均共面
D. CH![]() 与OH-形成的化合物中含有离子键
与OH-形成的化合物中含有离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com