
科目: 来源: 题型:
【题目】几种有机物的相互转化如图:
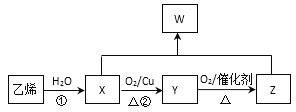
请回答:
(1)乙烯的电子式是_____________
(2)反应①的反应类型是__________
(3)X→Y的方程式是______________________
(4)X+Z→W的方程式是_____________,实验室常用图所示的装置实现这一转化
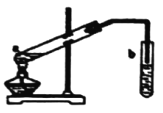
①试管b中一般加入____溶液
②从试管b中分离出W的方法是___________
查看答案和解析>>
科目: 来源: 题型:
【题目】材料的发展与应用促进了人类社会的进步
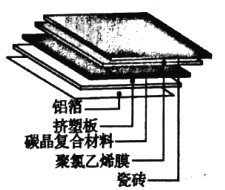
(1)碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是_____;属于硅酸盐材料的是____;属于高分子材料的是挤塑板和______
(2)吸附材料具有多孔、表面积大的特点,活性炭吸附![]() 的过程中,会伴有C与
的过程中,会伴有C与![]() 的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
的反应,产物为两种常见无毒气体.写出该反应的化学方程式:_____________
(3)![]() 是锂离子电池的一种正极材料,可通过
是锂离子电池的一种正极材料,可通过![]() 与
与![]() 煅烧制备,同时还生成
煅烧制备,同时还生成![]() 和一种单质,写出该反应的化学方程式:________
和一种单质,写出该反应的化学方程式:________
(4)某原电池装置如图所示:
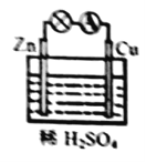
①负极的电极反应式是_______;
②当铜表面析出![]() 氢气(标准状况)时,导线中通过了____
氢气(标准状况)时,导线中通过了____![]() 电子
电子
查看答案和解析>>
科目: 来源: 题型:
【题目】航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,反应方程式表示为2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O。下列对该反应的叙述中错误的是( )
N2↑+Cl2↑+2O2↑+4H2O。下列对该反应的叙述中错误的是( )
A.瞬间产生大量高温气体推动航天飞机飞行
B.从能量变化的角度,主要是化学能转变为热能和动能
C.反应的焓变小于零
D.在方程式后增加ΔH及其数值即为热化学方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献.联合制碱法的主要过程如图所示(部分物质己略去)

(1)①~③所涉及的操作方法中,包含过滤的是________(填序号)
(2)根据上图,写出①中发生反应的化学方程式:________
(3)煅烧![]() 固体的化学方程式是_____________
固体的化学方程式是_____________
(4)下列说法中,正确的是________(填字母)
a.![]() 可循环使用
可循环使用
b.副产物![]() 可用作肥料
可用作肥料
c.溶液B中一定含有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用 Na2SO3 将Cr2O72— 还原为Cr3+。该反应的离子反应方程式为___________________________________。
(2)利用铬铁矿(FeOCr2O3)冶炼制取金属铬的工艺流程如图所示:
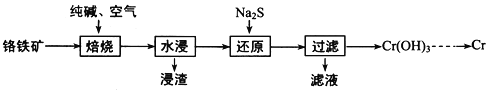
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②“水浸”要获得浸出液的操作是______。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则 “还原”操作中发生反应的离子方程式为____。
③加热Cr(OH)3可得到Cr2O3,从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是____。
(3)用石墨电极电解铬酸钠(Na2CrO4)溶液,可制重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O)。
+H2O)。
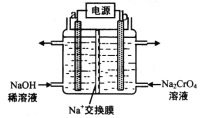
①电极b连接电源的______极(填“正”或“负”) , b 极发生的电极反应式为______。 ②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则理论上生成重铬酸钠的物质的量是 __________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃的衍生物A的化学式为C6H12O2,已知:

又知D不与Na2CO3反应,C和E均不能发生银镜反应,则A的结构可能有( )
A.2种B.3种C.4种D.6种
查看答案和解析>>
科目: 来源: 题型:
【题目】物质C为对甲氧基苯丙酰胺(相对分子质量为179)难溶于冷水的白色晶体,是一种医药中间体,可以由苯甲醚通过两步合成,如下图所示:
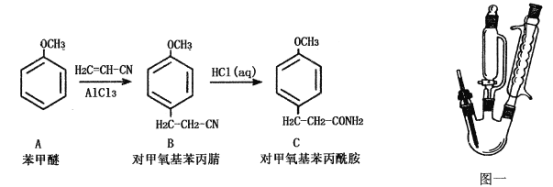
已知:无水三氯化铝遇水会发生强烈水解并放热。
①步骤一:用图一装置合成对甲氧基苯丙腈(B)
在500 mL三颈烧瓶中,加入108 g(1.00 mol)苯甲醚(A),室温下缓慢加入70g(0.52 mol)粉末状三氯化铝,加入过程中温度不超过25℃,加完后降温至5℃,逐滴加入130g(2.45 mol)丙烯腈,滴加结束后再升温至90~95℃,反应2小时。将反应物倒入500g冰水中,搅匀,静置分层,分出油相。减压蒸馏,收集150~160℃/2.67kPa馏分,得到对甲氧基苯丙腈。
②步骤二:对甲氧基苯丙酰胺(C)的合成
将上述反应合成的对甲氧基苯丙腈加入到500 mL三颈烧瓶中,加入300 mL浓盐酸,再经过一系列操作后得对甲氧基苯丙酰胺133.7g。
(1)对甲氧基苯丙腈(B)的合成过程中宜采用的加热方式:____________
(2)图一中合成对甲氧基苯丙腈(B)的装置有一缺陷,请提出改进方法并说明理由:_________
(3)用恒压滴液漏斗加丙烯腈的优点:___________________________________(写出两条);
(4)下列操作为步骤二对甲氧基苯丙酰胺(C)合成过程中加浓盐酸后的一系列操作,请排出下列操作的合理顺序:____________________________________;
①加入活性炭回流0.5h ②趁热过滤 ③抽滤 ④将滤液慢慢倒入1000g冷水中,析出晶体⑤升温至40~50℃,搅拌1h ⑥洗涤、烘干
(5)下列关于实验操作的说法错误的是:__________
A.减压蒸馏采用如图二所示装置,装置中的D为毛细管,也可以用沸石代替
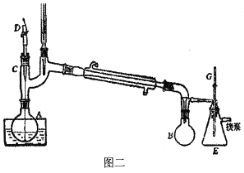
B.减压蒸馏过程中,可以通过控制G处的旋塞停止减压
C.在步骤二,对甲氧基苯丙酰胺(C)的合成过程中,析出的晶体可以用冷水洗涤
D.在步骤二,抽滤后洗涤晶体时,应先关小水龙头,使洗涤剂浸没晶体后,再打开水龙头进行抽滤
E.减压过滤不宜用于过滤颗粒太小的沉淀,因为颗粒太小的沉淀在快速过滤时易透过滤纸
(6)本实验制得的对甲氧基苯丙酰胺的产率为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】为纪念迪米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”.元素周期表是科学界最重要的成就之一,表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.
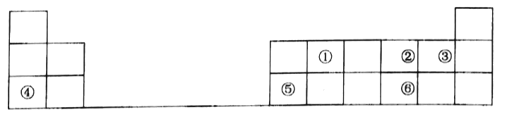
请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)______;用原子结构解释原因,理由是:_________
(2)元素②与⑥的氢化物的稳定性顺序为________(填化学式);
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为__________
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是___
查看答案和解析>>
科目: 来源: 题型:
【题目】利用光伏电池与膜电解法制备Ce(SO4)2溶液的装置如下图所示,下列说法正确的是()
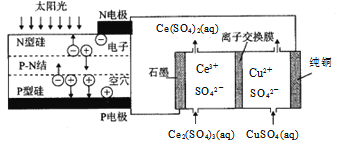
A.该装置工作时的能量形式只有两种
B.石墨电极发生反应:Ce4+ + e- = Ce3+
C.该离子交换膜为阴离子交换膜,SO42-由左池向右池迁移
D.由P电极向N电极转移![]() 电子时,阳极室生成33.2g Ce(SO4)2
电子时,阳极室生成33.2g Ce(SO4)2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2;②KClO3+6HCl=3Cl2↑+KCl+3H2O;③2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是:( )
A.①中KCl 是氧化产物,KBr发生还原反应
B.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
C.反应②中氧化剂与还原剂的物质的量之比为1:6
D.③中1 mol氧化剂参加反应得到电子的物质的量为2.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com