
科目: 来源: 题型:
【题目】X、Y、Z、M、Q、R是元素周期表前四周期元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 原子核外有6种不同运动状态的电子 |
Y | 基态原子中s电子总数与p电子总数相等 |
Z | 原子半径在同周期元素中最大 |
M | 逐级电离能(kJ/mol)依次为 578、1 817、2 745、11 575、14 830、18 376 |
Q | 基态原子的最外层p轨道上有两个电子的自旋方向与其他电子的自旋方向相反 |
R | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
请用化学用语填空:
(1)请写出Q元素基态原子的外围电子排布图:_______。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序是__________(用元素符号表示)。
(3)R元素可形成R2+和R3+,其中较稳定的是R3+,原因是__________。
(4)写出Z元素的原子核外电子排布式_________。
(5)Q元素原子的未成对电子个数是________ 个。
查看答案和解析>>
科目: 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+HNO3(稀)——Mg(NO3)2+NO↑+H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目_____________。
(2)该反应中,还原产物是_________,HNO3表现了___________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。还原剂与氧化剂的的物质的量之比为____________。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如下。

已知:
ⅰ. 
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是___________,反应类型是___________________________。
(2)D中含有的官能团:__________________。
(3)E的结构简式为__________________。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为__________________。
(5)M是J的同分异构体,符合下列条件的M的结构简式是__________________。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是__________________。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入5 mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
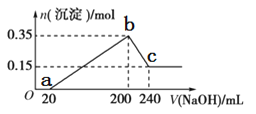
(1)写出Al与NaOH溶液反应的化学方程式___________________;
(2)镁和铝的总质量为________g;
(3)b点溶液中的溶质为__________,硫酸的物质的量浓度为___________ mol/L;
(4)生成的氢气在标准状况下的体积为__________L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,其沸点为-5.5℃,易水解。已知:AgNO2微溶于水,能溶于硝酸,AgNO2+HNO3=AgNO3 +HNO2,某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验装置如图所示。
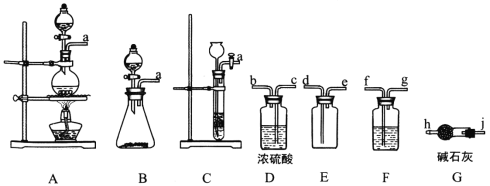
(1)制备Cl2的发生装置可以选用___________(填字母代号)装置,发生反应的化学方程式为_______________________________________________。
(2)欲收集一瓶干燥的氯气,选择合适的装置,其连接顺序为 A→_______→_______→________→_______ (按气流方向,用装置的大写字母表示)。
(3)实验室可用图示装置制备亚硝酰氯:
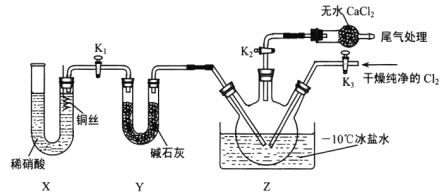
①实验室也可用 B装置制备NO,与B装置相比 X装置的优点为____________。
②检验装置气密性并装入药品,打开K2,然后再打开K3,通入一段时间气体,其目的是______,然后打开K1,当Z中有一定量液体生成时,停止实验。
(4)已知:ClNO 与H2O反应生成HNO2和 HCl。通过以下实验测定ClNO样品的纯度。取Z中所得液体m g 溶于水,配制成250 mL 溶液;取出25.00 mL样品溶于锥形瓶中,以K2CrO4溶液为指示剂,用c molL-1 AgNO3标准溶液滴定至终点,消耗标准溶液的体积为20.00mL。滴定终点的现象是____,亚硝酰氯(ClNO)的质量分数为_____。(已知:Ag2CrO4为砖红色固体; Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12)
查看答案和解析>>
科目: 来源: 题型:
【题目】合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(4)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:
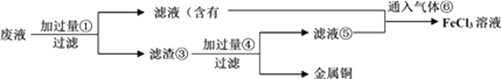
请写出上述实验中加入或生成的有关物质的化学式④____________。
(5)写出向⑤的混合液中通入⑥的离子方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:一个碳原子上连多个羟基时不稳定:![]() 。烃A有如下的转化关系:
。烃A有如下的转化关系:
![]() 写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
写出物质C的结构简式: ______ ,反应⑥的反应类型是 ______ 。
![]() 中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
中含氧官能团的名称为 ______ ,D的核磁共振氢谱中将会出现 ______ 组吸收峰。
![]() 写出C与银氨溶液反应的化学方程式: ______ 。
写出C与银氨溶液反应的化学方程式: ______ 。
![]() 与G具有相同官能团的同分异构体有四种,其中两种为:
与G具有相同官能团的同分异构体有四种,其中两种为: 请写出其它两种的结构简式: ______ 、 ______ 。
请写出其它两种的结构简式: ______ 、 ______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
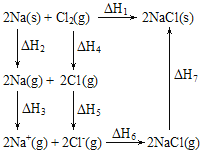
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
查看答案和解析>>
科目: 来源: 题型:
【题目】“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战!”以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)工业上采用NH3-SCR法是消除氮氧化物的常用方法。它利用氨在一定条件下将NOx在脱硝装置中转化为N2。主要反应原理为:主反应:
a.4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH1
4N2(g)+6H2O(g) ΔH1
副反应:b.4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
2N2(g)+6H2O(g) ΔH2=-1267.1kJ/mol
c.4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
4NO(g)+6H2O(g) ΔH3=-907.3kJ/mol
①上述反应中利用了NH3的__________性质;ΔH1=____________。
②将氮氧化合物按一定的流速通过脱硝装置,测得出口的NO残留浓度与温度的关系如图1,试分析脱硝的适宜温度是______(填序号)。
A.<850℃ b.900~1000℃ c.>1050℃
温度超过1000℃,NO浓度升高的原因是_____________________________________。
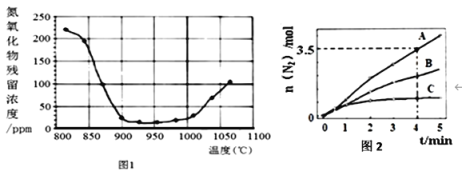
(2)已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
7N2(g) +12H2O(l) ΔH<0。相同条件下,在2 L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图2所示。下列说法正确的是_______(填标号)。
a.使用催化剂A达平衡时,ΔH值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
(3)为避免汽车尾气中的氮氧化合物对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746.8k·mol-1,实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,v正___v逆(填“>”“<”或“=”)。
②若在1L的密闭容器中充入1mol CO和1mol NO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。(分数表示)。
=___________。(分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com