
科目: 来源: 题型:
【题目】(化学一选修3:物质结构与性质)1735年瑞典化学家布兰特(G·Brands)制出金属钴。钴的矿物或钴的化合物一直用作陶瓷、玻璃、珐琅的釉料。到20世纪,钴及其合金在电机、机械、化工、航空和航天等工业部门得到广泛的应用,并成为一种重要的战略金属。所以钴及其化合物具有重要作用,回答下列问题:
(1)基态Co原子的电子排布式为___________。
(2)[Co(NH3)5H2O]Cl3是一种砖红色的晶体,可通过CoCl2、NH4Cl、浓氨水、H2O2制得。
①Co、N、0原子的第一电离能由大到小的顺序是__________。
②[Co(NH3)5H2O]Cl3中Co元素化合价为____,其配位原子为_____;1mol该晶体中含有____molσ键。
③H2O2中O原子的杂化轨道类型是______,H2O2能与水互溶,除都是极性分子外,还因为____。
④NH3、NF3的空间构型都相同,但Co3+易与NH3形成配离子,而NF3不能。原因是________。
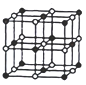
(3)CoO晶胞如图,已知Co原子半径为apm,O原子半径为bpm,则等距最近的所有O原子围成的空间形状为_____;该晶胞中原子的空间利用率为__________(用含a、b的计算式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。请回答:
![]() 基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与
基态铜原子的电子排布式为 ______ ;从铜原子价层电子结构变化角度来看,高温时CuO与![]() 的稳定性是CuO ______
的稳定性是CuO ______ ![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“
硒、硅均能与氢元素形成气态氢化物,则它们形成的组成最简单的氢化物中,分子构型分别为 ______ ,若“![]() ”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______
”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为Se ______ ![]() 填“
填“![]() ”、“
”、“![]() ”
”![]() 。
。
![]() 常温下白色晶体,熔点为
常温下白色晶体,熔点为![]() ,
,![]() 时升华,则
时升华,则![]() 固体的晶体类型为 ______ ;
固体的晶体类型为 ______ ;![]() 分子中Se原子的杂化类型为 ______ 。
分子中Se原子的杂化类型为 ______ 。
![]() 镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性
镓元素在元素周期表中的位置是 ______ ,该族元素都具有缺电子性![]() 价电子数少于价层轨道数
价电子数少于价层轨道数![]() ,其化合物可与具有孤对电子的分子或离子生成配合物,如
,其化合物可与具有孤对电子的分子或离子生成配合物,如![]() 能与
能与![]() 反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
反应生成BF3·NH3,BF3·NH3的结构简式可表示为 ______ 。
![]() 金刚砂
金刚砂![]() 的晶胞结构如图所示:
的晶胞结构如图所示:
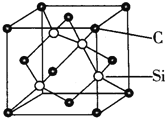
则在SiC中,每个C原子周围紧邻的C原子数目为 ______ 个;若晶胞的边长为apm,则金刚砂的密度为 ______ ![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.工业上常用电解NaCl溶液制备金属钠
B.在医疗上碳酸钠是治疗胃酸过多的一种药剂
C.过量的铁在氯气中燃烧可生成氯化亚铁
D.金属镁燃烧时发出耀眼的白光,因此常用来制造信号弹和焰火
查看答案和解析>>
科目: 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As 原子的核外电子排布式_____________。
(2)根据元素周期律,原子半径 Ga_____________As(填“>”或“<”,下同),第一电离能 Ga_____________As。
(3)AsCl3 分子的立体构型为_____________。
(4)锗(Ge)是典型的半导体元素,比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因_____________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约 400 |
查看答案和解析>>
科目: 来源: 题型:
【题目】氟他胺 G 是一种可用于治疗肿瘤的药物。实验室由芳香烃 A 制备 G 的合成路线如下:
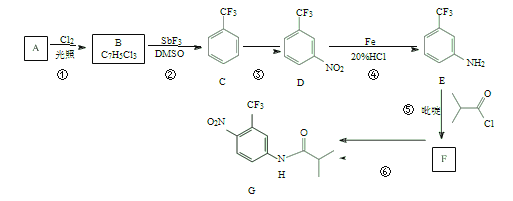
回答下列问题:
(1)C 的名称是_____________。
(2)③的反应试剂和反应条件分别是_____________,该反应类型是_____________。
(3)⑤的反应方程式为______________。
(4)G 的分子式为_____________。
(5)H 是G 的同分异构体,其苯环上的取代基与G 的相同但位置不同,则H 可能的结构有_____________种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备 4-甲氧基乙酰苯胺的合成路线______________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,其他试剂任选)
)制备 4-甲氧基乙酰苯胺的合成路线______________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,其他试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+![]() Zn+(1+
Zn+(1+![]() ) H2O+
) H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
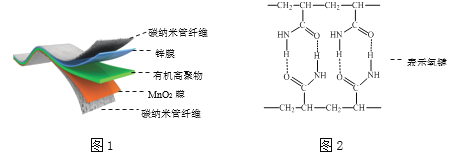
下列说法中,不正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.合成有机高聚物的单体是:![]()
C.充电时,Zn2+移向Zn膜
D.放电时,电池的正极反应为:MnO2 + e + H+ = MnOOH
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。

下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物X的结构如图所示,下列说法正确的是
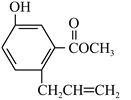
A. 1 mol X最多能与3 mol NaOH反应
B. X能与碳酸钠溶液产生二氧化碳
C. 1 mol X和浓溴水反应时,能消耗3 mol Br2
D. 1 mol X能最多能与5mol H2加成
查看答案和解析>>
科目: 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物![]() 浓度均为
浓度均为![]() 溶液的pH和原子序数的关系如图所示。
溶液的pH和原子序数的关系如图所示。

![]() 元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
元素R在周期表中的位置是______;元素Z的原子结构示意图是______。
![]() 元素Y和W形成的
元素Y和W形成的![]() 型化合物中含有化学键的类型为______。
型化合物中含有化学键的类型为______。
![]() 短周期元素C、O、S能形成多种化合物,如
短周期元素C、O、S能形成多种化合物,如![]() 、
、![]() 、COS等。
、COS等。
![]() 下列能说明碳、硫两种元素非金属性相对强弱的是______
下列能说明碳、硫两种元素非金属性相对强弱的是______![]() 填序号
填序号![]()
A.S与![]() 发生化合反应比C与
发生化合反应比C与![]() 化合更容易
化合更容易
B.酸性:![]()
C.![]() 中碳元素为
中碳元素为![]() 价,硫元素为
价,硫元素为![]() 价
价
![]() 铅
铅![]() 、锡
、锡![]() 、锗
、锗![]() 与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
![]() 锗的原子序数为______。
锗的原子序数为______。
![]() 它们
它们![]() 价氢氧化物的碱性由强到弱顺序为______
价氢氧化物的碱性由强到弱顺序为______![]() 填化学式
填化学式![]() 。
。
![]() 羰基硫
羰基硫![]() 可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和
可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和![]() 相似。
相似。
![]() 用电子式表示羰基硫
用电子式表示羰基硫![]() 的形成过程:______。
的形成过程:______。
![]() 羰基硫
羰基硫![]() 用氢氧化钠溶液处理及利用的过程如图:
用氢氧化钠溶液处理及利用的过程如图:

已知A是一种正盐,则A的化学式为______;若气体a为单质,反应II的离子方程式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
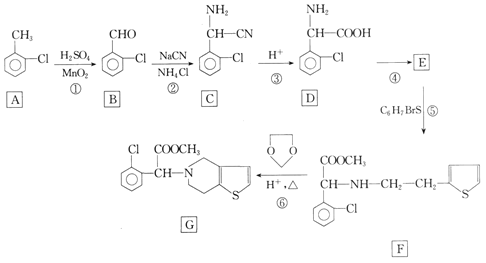
回答下列问题:
(1)①的反应类型为___。
(2)有机物D所含官能团的名称是___。
(3)反应④所需的试剂和条件分别是___和___。
(4)反应⑥生成G和X两种有机物,X的一种主要用途是___。
(5)反应⑤的化学反应方程式为___(反应物C6H7BrS用结构简式表示)。
(6)写出满足下列条件的D的同分异构体的结构简式:___(不考虑立体异构,写出一种即可)。
①苯环上含有三个不同取代基;②含酯基且能发生银镜反应;③含氨基但与苯环不直接相连。
(7)设计由对甲基苯甲醇制备![]() 的合成路线(无机试剂任选)___。
的合成路线(无机试剂任选)___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com