
科目: 来源: 题型:
【题目】某固体粉末X中可能含有K2SO4、(NH4)2CO3、NaNO3 、K2SO3、Cu2O、FeO、Fe2O3中几种。为确定其组成,某同学进行如下实验:
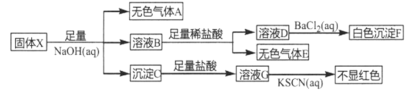
已知: Cu2O+2H+= Cu2++Cu+ H2O
根据实验过程及现象,下列说法正确的是
A.无色气体A可用湿润的蓝色石蕊试纸检验
B.固体X中一定含有(NH4)2CO3、K2SO3、FeO
C.无色气体E一定含有CO2,一定不含SO2.
D.固体X中可能含有Cu2O、Fe2O3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)Q(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其它条件不变,将容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆反应方向移动
B.Y可能是固体或液体
C.化学计量数n>m
D.Z的体积分数减小
查看答案和解析>>
科目: 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。试回答下列问题:
(1)Ni2+电子排布中,电子填充的能量最高的能级符号为______。
(2)金属Ni能与CO形成配合物Ni(CO)4.与CO互为等电子体的一种分子为______(写化学式,下同),与CO互为等电子体的一种离子为______。
(3)丁二酮肟(![]() )是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
)是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为______,2mol丁二酮肟分子中所含σ键的数目为______。
(4)丁二酮肟常与NI2+形成图A所示的配合物,图B是硫代氧的结果:
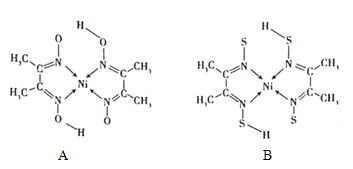
①A的熔、沸点高于B的原因为______。
②B晶体含有化学键的类型为______(填选项字母)。
A.σ键B.金属键C.配位键D.π键
(5)人工合成的氧化镍往往存在缺陷,某缺陷氧化银的组成为Ni0.97O,其中Ni元素只有+2和+3两种价态,两种价态的镍离子数目之比为______。
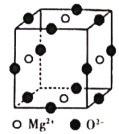
(6)Ni2+与Mg2+、O2-形成晶体的晶胞结构如图所示(Ni2+未画出),则该晶体的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】过一硫酸氢钾复合盐(KHSO4·2KHSO5·K2SO4)常用作漂白剂和消毒剂,其制备流程如图:
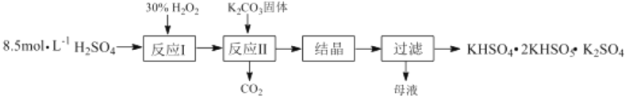
(1)反应Ⅰ的化学方程式为:H2O2+H2SO4H2SO5+H2O,△H<0;则反应Ⅱ中K2CO3与H2SO5反应生成KHSO5的化学方程式为___。
(2)生产原料的理论比值[n(H2O2):n(H2SO4)]为0.4:1,但实际生产最佳投料比为0.6:1,其原因是___。
(3)准确称取3.350g复合盐样品配制成250mL溶液,取25.00mL置于锥形瓶中,加入适量的稀硫酸和足量的KI溶液,摇匀后置于暗处,充分反应后,加入少量淀粉溶液,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消粍标准溶液20.00mL。计算复合盐中有效成分KHSO5的质量分数。(写出计算过程)(已知:HSO5-+I-+H+→SO42-+I2+H2O,I2+S2O32-→I-+S4O62--未配平)___。
查看答案和解析>>
科目: 来源: 题型:
【题目】有3.2g CuO、Fe2O3 混合物跟足量CO充分反应后固体减少了0.72g,反应后全部气体用50mL 0.7mol·L-1 Ba(OH)2溶液吸收。下列有关叙述中正确的是
A.反应中生成的CO2体积为1.008 L
B.吸收CO2后的溶液中一定不含Ba(HCO3)2
C.原混合物中CuO与Fe2O3 质量比为3:1
D.若将质量相同的混合物加过量硫酸溶解后,再加入100mLNaOH溶液时沉淀达最大量,由此可求得c(NaOH)= 0.75 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为________。
(2)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式为:![]() ,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/ mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题:
①前2s内的平均反应速率υ(N2)=____;
②上述条件下,该反应的平衡常数为____;
③上述条件下,测得某时刻反应体系中各物质的物质的量浓度均为0.01mol/L,则此时反应处于___状态。(填“平衡”或“向右进行”或“向左进行”)
(3)实验室常用0.10mol/L KMnO4标准酸性溶液来测定H2C2O4样品的纯度(标准液滴待测液),其反应原理为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O。
①KMnO4标准液应装在____(填“酸式”或“碱式”)滴定管;
②清水洗净滴定管后直接装入标准液,则测定结果会____;(填“偏大”或“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:
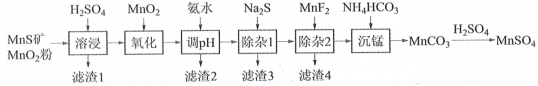
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀![]() pH范围如下:
pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8 3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)写出基态锰原子核外电子排布式___。
(2)“氧化”中添加适量的MnO2发生反应的离子方程式是___。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___~6之间。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___。
(5)写出“沉锰”的离子方程式___。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___。
时,z=___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在两个绝热恒容的密闭容器中分别进行下列两个可逆反应:
甲:C(s)+H2O(g) ![]() CO(g)+H2(g);
CO(g)+H2(g);
乙:CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:
①混合气体平均相对分子质量不再改变
②气体的总物质的量不再改变
③各气体组成浓度相等
④反应体系中温度保持不变
⑤断裂氢氧键速率是断裂氢氢键速率的2倍
⑥混合气体密度不变
其中能表明甲、乙容器中反应都达到平衡状态的是
A. ①③B. ④⑤C. ③④D. ②⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )

①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐②Y、Z的气态氢化物的水溶液的酸性:Y<Z③Z的单质在常温下是液体,可与铁粉反应④Z的原子序数比Y大19⑤Z所在的周期中含有32种元素
A.①②③④B.①②③④⑤C.只有③D.只有①④
查看答案和解析>>
科目: 来源: 题型:
【题目】如图形象地表示氯化钠的形成过程。下列相关的叙述中不正确的是( )

A.钠原子易失去一个原子,氯原子易得到一个电子
B.钠离子与钠原子有相似的化学性质
C.钠原子与氯原子作用形成![]() 后,其结构的稳定性增强
后,其结构的稳定性增强
D.氯化钠中微粒之间形成离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com